NEMESIS, Neuroinflammation & Multiple Sclerosis

Présentation de l'équipe
Notre équipe de recherche émergente est intégrée au sein de l’institut de recherche Lille Neuroscience & Cognition situé sur le campus du CHU de Lille.
Le laboratoire propose une collaborations entre scientifiques fondamentaux et cliniciens. Cette pluridisciplinarité enrichit la formation des étudiants MSc / PhD et post-doctorants accueillis dans notre environnement.
Notre domaine d’intérêt concerne les maladies inflammatoires du cerveau et de la moelle épinière qui peuvent être particulièrement néfastes en raison de la faible capacité de régénération du système nerveux central (SNC). Spécialisé dans la sclérose en plaques (SEP) et le trouble du spectre de la neuromyélite (NMOSD), le périmètre de notre laboratoire comprend des soins innovants aux patients via des essais cliniques et des recherches sur les biomarqueurs, ainsi que des recherches fondamentales visant à élucider la physiopathologie de la démyélinisation auto-immune.
Notre recherche translationnelle en cours traite de l’impact de l’immuno-sénescence, des cellules B, de la microglie et des modifications post-traductionnelles en tant que nouveaux médiateurs de la neuroinflammation. Nous contribuons activement aux essais cliniques ciblant ces nouveaux signaux thérapeutiques afin de faire progresser la gestion clinique de la SEP.
À LA UNE

Dr MARS, lauréat du prix MS innovation 2020

- PERSONNEL
- THÈMES DE RECHERCHE
- PRODUCTIONS SCIENTIFIQUES
Responsables de Projets
 | Dr. Lennart Mars |
 | Pr. Hélène Zéphir, MD, Ph.D., PU-PH |
 | Pr. Patrick Vermersch, MD, Ph.D., PU-PH |
| |
 | Nathalie Journiac, |
 | Dr. Edmone Dewaeles, PhD Ingénieure d'Etude (Université de Lille) Biologiste Moléculaire |
| |
 | Shin-Yi YU, Post Doc, PhD |
| |
 | Laure Deramoudt (IPR), PhD, Interne en pharmacie, Doctorante |
 | Dr Bruno Lemarchant, MD, MSc/Doctorant |
 | Gatien Durand, Interne en Pharmacie, MSc/Doctorant |
 | Xavier Biardeau, Médecin, Doctorant |
 | Marion Prono, PharmD, Doctorante |
| |
 | Dr Florent Salvador, PhD |
 | Dr Mathilde Bas, PharmD, PhD Scientifique, Merck Life Science |
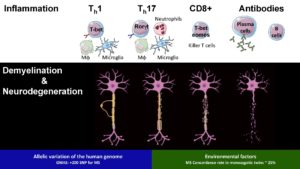
Le système nerveux central (SNC) est classiquement considéré comme un environnement immunitaire privilégié dans lequel les immunogènes peuvent persister dans le parenchyme sans provoquer de réponse immunitaire adaptative. Malgré cette caractéristique, le SNC n'est pas immunodéprimé, car les réponses inflammatoires locales attaquent les infections microbiennes et s'atténuent après l'élimination des agents pathogènes. Cela indique que le SNC peut contrôler intrinsèquement l'activité immunitaire et peut se mobiliser contre les lésions tissulaires à médiation immunitaire collatérales.
Nous étudions la dérégulation de ces interactions neuro-immunes dans le contexte de la sclérose en plaques et de la maladie de Devics avec les trois objectifs suivants:
Anticorps et Fc-glycosylation dans la neuroinflammation auto-immune.
La maladie de Devic est une maladie inflammatoire étiologiquement hétérogène qui affecte le nerf optique et la moelle épinière. Contrairement à la sclérose en plaques, une réponse d'autoanticorps neurale focalisée est essentielle pour provoquer la disparition pathogène des cellules gliales et des neurones du SNC. La spécificité de la réponse humorale a permis d'identifier 2 sous-ensembles avec une physiopathologie distincte. Anticorps dirigés contre l'aquaporine-4 (AQP-4); une protéine du canal de l'eau exprimée à la surface cellulaire des astrocytes du SNC sous-tend les troubles du spectre de Neuromyelitis optica. La démyélinisation progresse à partir d'une astropathie auto-immune qui peut être traitée par neutralisation de la réponse humorale en éliminant les lymphocytes B, ou en neutralisant le complément ou l'IL-6. Un deuxième sous-ensemble est caractérisé par des anticorps ciblant la glycoprotéine oligodendrocyte de myéline (MOG), un composant mineur de la myéline du SNC synthétisée par les oligodendrocytes. Cliniquement, MOGAD se manifeste par une névrite optique, mais peut impliquer une myélite ou, chez les enfants, une encéphalomyélite aiguë disséminée (ADEM) et une encéphalite auto-immune.
Les anticorps (Abs) exercent leur fonction en se liant à des récepteurs Fc distincts et au complément. L'affinité de ces interactions est traditionnellement attribuée à l'isotype Ab. Au moins pour les IgG, ce point de vue évolue. Les glycanes N-liés sont de plus en plus proposés pour influencer la liaison aux récepteurs Fc-gamma classiques (FcyR) et permettre la liaison à des récepteurs de type II non classiques. L'impact de cette nouvelle fonctionnalité Fc sur la réponse humorale dans les maladies inflammatoires du système nerveux central n'est pas connu. Nous définissons ces nouveaux traits de la réponse humorale pour la SEP, le NMOSD et le MOGAD à l'aide de diverses approches translationnelles.
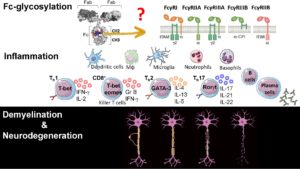
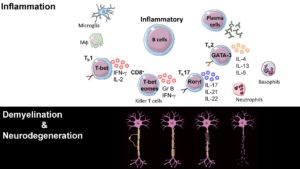
Pathogénicité indépendante des anticorps des cellules B
Sans aucun doute une maladie auto-immune, la SEP mobilise le plein souffle de la réponse immunitaire innée et adaptative. La maladie récurrente-rémittente est provoquée par une infiltration récurrente de cellules immunitaires provoquant des lésions démyélinisantes focales et des cicatrices axonales. Une neurodégénérescence plus prononcée s'ensuit dans la SEP progressive au cours de laquelle la réponse inflammatoire se structure dans le système nerveux central. Cette réponse immunitaire compartimentée du SNC persiste sans vagues d'infiltration immunitaire en présence d'une barrière hémato-encéphalique intacte. La neuroinflammation dans le parenchyme est complétée par l'apparition de follicules lymphoïdes ectopiques (ELF) dans les méninges qui entraînent la démyélinisation corticale et la disparition neuronale. Cette complexité de la réponse inflammatoire dans la SEP va au-delà de l'autoréactivité, impliquant une dérégulation immunitaire causée par une prédisposition génétique, une immuno-sénescence progressive et le vieillissement, et aux derniers stades une neurodégénérescence immunitaire indépendante. Nous travaillons sur un nouveau sous-ensemble de cellules B qui se développe chez les personnes âgées (> 65 ans) et contribue à la sénescence immunitaire CD8.
 Innovation de traitement et gestion clinique
La dernière décennie a vu des progrès remarquables dans la compréhension et la prise en charge clinique de la sclérose en plaques (SEP). Une évolution similaire est attendue pour le NMOSD et le MOGAD étant donné les progrès dans la compréhension de leur physiopathologie sous-jacente. Nous contribuons à l'innovation thérapeutique en participant à des essais cliniques visant à améliorer les traitements immunomodulateurs, à promouvoir la guérison des tissus par des stratégies de neuroprotection ou de remyélinisation, ou encore à faire taire la réponse immunitaire innée au sein du SNC. Nous explorons les mécanismes d'action des biothérapies MS, investissons dans le développement de biomarqueurs et développons de nouvelles stratégies basées sur notre recherche fondamentale.
Brevets:
2019 Highly sialylated autoantibodies and uses thereof. INSERM / LFB Biotechnologies. Inventors : Mars LT, Monnet C. WO 2019/202153 A1 / FR3080376A1.
2014 Compounds, pharmaceutical composition and their use in treating neurodegenerative diseases. Melnyk P, Vermersch P, Carato P, Vanteghem-Oxombre B, Zephir H, Donnier-Maréchal M. Brevet européen déposé le 16 juin 2014 sous le n° EP14305919.4.
Innovation de traitement et gestion clinique
La dernière décennie a vu des progrès remarquables dans la compréhension et la prise en charge clinique de la sclérose en plaques (SEP). Une évolution similaire est attendue pour le NMOSD et le MOGAD étant donné les progrès dans la compréhension de leur physiopathologie sous-jacente. Nous contribuons à l'innovation thérapeutique en participant à des essais cliniques visant à améliorer les traitements immunomodulateurs, à promouvoir la guérison des tissus par des stratégies de neuroprotection ou de remyélinisation, ou encore à faire taire la réponse immunitaire innée au sein du SNC. Nous explorons les mécanismes d'action des biothérapies MS, investissons dans le développement de biomarqueurs et développons de nouvelles stratégies basées sur notre recherche fondamentale.
Brevets:
2019 Highly sialylated autoantibodies and uses thereof. INSERM / LFB Biotechnologies. Inventors : Mars LT, Monnet C. WO 2019/202153 A1 / FR3080376A1.
2014 Compounds, pharmaceutical composition and their use in treating neurodegenerative diseases. Melnyk P, Vermersch P, Carato P, Vanteghem-Oxombre B, Zephir H, Donnier-Maréchal M. Brevet européen déposé le 16 juin 2014 sous le n° EP14305919.4. Articles originaux
2020
Cell Metabolic Alterations due to Mcph1 Mutation in Microcephaly.
Journiac N, Gilabert-Juan J, Cipriani S, Benit P, Liu X, Jacquier S, Faivre V, Delahaye-Duriez A, Csaba Z, Hourcade T, Melinte E, Lebon S, Violle-Poirsier C, Oury JF, Adle-Biassette H, Wang ZQ, Mani S, Rustin P, Gressens P, Nardelli J.
Cell Rep. 2020 Apr 14;31(2):107506. doi: 10.1016/j.celrep.2020.03.070.
Efficacy of cladribine tablets in high disease activity patients with relapsing multiple sclerosis: Post hoc analysis of subgroups with and without prior disease-modifying drug treatment.
Vermersch P, Galazka A, Dangond F, Damian D, Wong SL, Jack D, Harty G.
Curr Med Res Opin. 2020 Dec 17:1. doi: 10.1080/03007995.2020.1865888.
Siponimod and cognition in secondary progressive multiple sclerosis: EXPAND secondary analyses.
Benedict RHB, Tomic D, Cree BA, Fox R, Giovannoni G, Bar-Or A, Gold R, Vermersch P, Pohlmann H, Wright I, Karlsson G, Dahlke F, Wolf C, Kappos L.
Neurology. 2020 Dec 16:10.1212/WNL.0000000000011275. doi: 10.1212/WNL.0000000000011275.
An analysis of first-line disease-modifying therapies in patients with relapsing-remitting multiple sclerosis using the French nationwide health claims database from 2014-2017.
Vermersch P, Suchet L, Colamarino R, Laurendeau C, Detournay B.
Mult Scler Relat Disord. 2020 Nov;46:102521. doi: 10.1016/j.msard.2020.102521.
Clinical Features and Risk of Relapse in Children and Adults with Myelin Oligodendrocyte Glycoprotein Antibody-Associated Disease.
Cobo-Calvo A, Ruiz A, Rollot F, Arrambide G, Deschamps R, Maillart E, Papeix C, Audoin B, Lépine AF, Maurey H, Zephir H, Biotti D, Ciron J, Durand-Dubief F, Collongues N, Ayrignac X, Labauge P, Meyer P, Thouvenot E, Bourre B, Montcuquet A, Cohen M, Horello P, Tintoré M, De Seze J, Vukusic S, Deiva K, Marignier R; NOMADMUS, KidBioSEP, and OFSEP study groups.
Ann Neurol. 2021 Jan;89(1):30-41. doi: 10.1002/ana.25909.
Optical coherence tomography for detection of asymptomatic optic nerve lesions in clinically isolated syndrome.
Outteryck O, Lopes R, Drumez É, Labreuche J, Lannoy J, Hadhoum N, Boucher J, Vermersch P, Zedet M, Pruvo JP, Zéphir H, Leclerc X.
Neurology. 2020 Aug 11;95(6):e733-e744. doi: 10.1212/WNL.0000000000009832.
Clinical Characteristics and Outcomes in Patients With Coronavirus Disease 2019 and Multiple Sclerosis.
Louapre C, Collongues N, Stankoff B, Giannesini C, Papeix C, Bensa C, Deschamps R, Créange A, Wahab A, Pelletier J, Heinzlef O, Labauge P, Guilloton L, Ahle G, Goudot M, Bigaut K, Laplaud DA, Vukusic S, Lubetzki C, De Sèze J; Covisep investigators, Derouiche F, Tourbah A, Mathey G, Théaudin M, Sellal F, Dugay MH, Zéphir H, Vermersch P, Durand-Dubief F, Françoise R, Androdias- Condemine G, Pique J, Codjia P, Tilikete C, Marcaud V, Lebrun-Frenay C, Cohen M, Ungureanu A, Maillart E, Beigneux Y, Roux T, Corvol JC, Bordet A, Mathieu Y, Le Breton F, Boulos DD, Gout O, Guéguen A, Moulignier A, Boudot M, Chardain A, Coulette S, Manchon E, Ayache SS, Moreau T, Garcia PY, Kumaran D, Castelnovo G, Thouvenot E, Taithe F, Poupart J, Kwiatkowski A, Defer G, Derache N, Branger P, Biotti D, Ciron J, Clerc C, Vaillant M, Magy L, Montcuquet A, Kerschen P, Coustans M, Guennoc AM, Brochet B, Ouallet JC, Ruet A, Dulau C, Wiertlewski S, Berger E, Buch D, Bourre B, Pallix Guiot M, Maurousset A, Audoin B, Rico A, Maarouf A, Edan G, Papassin J, Videt D.
JAMA Neurol. 2020 Sep 1;77(9):1079-1088. doi: 10.1001/jamaneurol.2020.2581.
Teriflunomide vs injectable disease modifying therapies for relapsing forms of MS.
Vermersch P, Oh J, Cascione M, Oreja-Guevara C, Gobbi C, Travis LH, Myhr KM, Coyle PK.
Mult Scler Relat Disord. 2020 Aug;43:102158. doi: 10.1016/j.msard.2020.102158.
Asymptomatic optic nerve lesions: An underestimated cause of silent retinal atrophy in MS.
Davion JB, Lopes R, Drumez É, Labreuche J, Hadhoum N, Lannoy J, Vermersch P, Pruvo JP, Leclerc X, Zéphir H, Outteryck O.
Neurology. 2020 Jun 9;94(23):e2468-e2478. doi: 10.1212/WNL.0000000000009504.
Double-blind, randomized controlled trial of therapeutic plasma exchanges vs sham exchanges in moderate-to-severe relapses of multiple sclerosis.
Brochet B, Deloire M, Germain C, Ouallet JC, Wittkop L, Dulau C, Perez P, Thevenot F, De Sèze J, Zéphir H, Vermersch P, Pittion S, Debouverie M, Laplaud DA, Clavelou P, Ruet A.
J Clin Apher. 2020 Aug;35(4):281-289. doi: 10.1002/jca.21788.
Evaluation of efficacy and tolerability of first-line therapies in NMOSD.
Poupart J, Giovannelli J, Deschamps R, Audoin B, Ciron J, Maillart E, Papeix C, Collongues N, Bourre B, Cohen M, Wiertlewski S, Outteryck O, Laplaud D, Vukusic S, Marignier R, Zephir H; NOMADMUS study group.
Neurology. 2020 Apr 14;94(15):e1645-e1656. doi: 10.1212/WNL.0000000000009245.
2019
Fc Sialylation Prolongs Serum Half-Life of Therapeutic Antibodies.
Bas M, Terrier A, Jacque E, Dehenne A, Pochet-Béghin V, Beghin C, Dezetter AS, Dupont G, Engrand A, Beaufils B, Mondon P, Fournier N, de Romeuf C, Jorieux S, Fontayne A, Mars LT. Monnet C.
J Immunol. 2019 Mar 1;202(5):1582-1594. doi: 10.4049/jimmunol.1800896.
The 5-year Tysabri global observational program in safety (TYGRIS) study confirms the long-term safety profile of natalizumab treatment in multiple sclerosis.
Foley J, Carrillo-Infante C, Smith J, Evans K, Ho PR, Lee L, Kasliwal R, Stangel M, Vermersch P, Hutchinson M, Marinelli F, Smirnakis K; TYGRIS investigators.
Mult Scler Relat Disord. 2019 Nov 21;39:101863. doi: 10.1016/j.msard.2019.101863.
Efficacy of alemtuzumab in relapsing- remitting MS patients who received additional courses after the initial two courses: Pooled analysis of the CARE-MS, extension, and TOPAZ studies.
Comi G, Alroughani R, Boster AL, Bass AD, Berkovich R, Fernández Ó, Kim HJ, Limmroth V, Lycke J, Macdonell RA, Sharrack B, Singer BA, Vermersch P, Wiendl H, Ziemssen T, Jacobs A, Daizadeh N, Rodriguez CE, Traboulsee A; CARE-MS I, CARE-MS II, CAMMS03409, and TOPAZ Investigators.
Mult Scler. 2020 Dec;26(14):1866-1876. doi: 10.1177/1352458519888610.
Efficacy of alemtuzumab over 6 years in relapsing-remitting multiple sclerosis patients who relapsed between courses 1 and 2: Post hoc analysis of the CARE-MS studies.
Van Wijmeersch B, Singer BA, Boster A, Broadley S, Fernández Ó, Freedman MS, Izquierdo G, Lycke J, Pozzilli C, Sharrack B, Steingo B, Wiendl H, Wray S, Ziemssen T, Chung L, Margolin DH, Thangavelu K, Vermersch P.
Mult Scler. 2020 Nov;26(13):1719-1728. doi: 10.1177/1352458519881759.
Expert opinion: Criteria for second- line treatment failure in patients with multiple sclerosis.
Vermersch P, De Sèze J, Clavelou P, Durand-Dubief F, Maillart E, Mekies C, Moreau T, Papeix C, Tourbah A, Labauge P.
Mult Scler Relat Disord. 2019 Nov;36:101406. doi: 10.1016/j.msard.2019.101406.
Progressive Multifocal Leukoencephalopathy Incidence and Risk Stratification Among Natalizumab Users in France.
Vukusic S, Rollot F, Casey R, Pique J, Marignier R, Mathey G, Edan G, Brassat D, Ruet A, De Sèze J, Maillart E, Zéphir H, Labauge P, Derache N, Lebrun-Frenay C, Moreau T, Wiertlewski S, Berger E, Moisset X, Rico-Lamy A, Stankoff B, Bensa C, Thouvenot E, Heinzlef O, Al-Khedr A, Bourre B, Vaillant M, Cabre P, Montcuquet A, Wahab A, Camdessanché JP, Tourbah A, Guennoc AM, Hankiewicz K, Patry I, Nifle C, Maubeuge N, Labeyrie C, Vermersch P, Laplaud DA; OFSEP Investigators.
JAMA Neurol. 2020 Jan 1;77(1):94-102. doi: 10.1001/jamaneurol.2019.2670.
Comparative effectiveness of teriflunomide vs dimethyl fumarate in multiple sclerosis.
Laplaud DA, Casey R, Barbin L, Debouverie M, De Sèze J, Brassat D, Wiertlewski S, Brochet B, Pelletier J, Vermersch P, Edan G, Lebrun-Frenay C, Clavelou P, Thouvenot E, Camdessanché JP, Tourbah A, Stankoff B, Al Khedr A, Cabre P, Lubetzki C, Papeix C, Berger E, Heinzlef O, Debroucker T, Moreau T, Gout O, Bourre B, Wahab A, Labauge P, Magy L, Defer G, Guennoc AM, Maubeuge N, Labeyrie C, Patry I, Nifle C, Casez O, Michel L, Rollot F, Leray E, Vukusic S, Foucher Y; SFSEP and OFSEP groups.
Neurology. 2019 Aug 13;93(7):e635-e646. doi: 10.1212/WNL.0000000000007938.
Evaluation of treatment response in adults with relapsing MOG-Ab-associated disease.
Cobo-Calvo A, Sepúlveda M, Rollot F, Armangué T, Ruiz A, Maillart E, Papeix C, Audoin B, Zephir H, Biotti D, Ciron J, Durand-Dubief F, Collongues N, Ayrignac X, Labauge P, Thouvenot E, Bourre B, Montcuquet A, Cohen M, Deschamps R, Solà-Valls N, Llufriu S, De Seze J, Blanco Y, Vukusic S, Saiz A, Marignier R.
J Neuroinflammation. 2019 Jul 2;16(1):134. doi: 10.1186/s12974-019-1525-1.
Switching for convenience from first-line injectable treatments to oral treatments in multiple sclerosis: Data from a retrospective cohort study.
Buard G, Giovannelli J, Outteryck O, Hadhoum N, Lannoy J, Vermersch P, Zéphir H.
Mult Scler Relat Disord. 2019 Aug;33:39-43. doi: 10.1016/j.msard.2019.05.015.
Frequency and characteristics of short versus longitudinally extensive myelitis in adults with MOG antibodies: A retrospective multicentric study.
Ciron J, Cobo-Calvo A, Audoin B, Bourre B, Brassat D, Cohen M, Collongues N, Deschamps R, Durand-Dubief F, Laplaud D, Maillart E, Papeix C, Zephir H, Bereau M, Brochet B, Carra Dallière C, Derache N, Gagou-Scherer C, Henry C, Kerschen P, Mathey G, Maubeuge N, Maurousset A, Montcuquet A, Moreau T, Prat C, Taithe F, Thouvenot E, Tourbah A, Rollot F, Vukusic S, Marignier R.
Mult Scler. 2020 Jul;26(8):936-944. doi: 10.1177/1352458519849511.
Optical coherence tomography: a window to the optic nerve in clinically isolated syndrome.
London F, Zéphir H, Drumez E, Labreuche J, Hadhoum N, Lannoy J, Hodel J, Vermersch P, Pruvo JP, Leclerc X, Outteryck O.
Brain. 2019 Apr 1;142(4):903-915. doi: 10.1093/brain/awz038.
Benefit-risk Assessment of Cladribine Using Multi-criteria Decision Analysis (MCDA) for Patients With Relapsing-remitting Multiple Sclerosis.
Vermersch P, Martinelli V, Pfleger C, Rieckmann P, Alonso-Magdalena L, Galazka A, Dangond F, Phillips L.
Clin Ther. 2019 Feb;41(2):249-260.e18. doi: 10.1016/j.clinthera.2018.12.015.
OFSEP Group; REEM Group. Correction to: Usefulness of MOG-antibody titres at first episode to predict the future clinical course in adults.
Cobo-Calvo A, Sepúlveda M, d'Indy H, Armangué T, Ruiz A, Maillart E, Papeix C, Audoin B, Zephir H, Biotti D, Ciron J, Durand-Dubief F, Collongues N, Ayrignac X, Labauge P, Thouvenot E, Montcuquet A, Deschamps R, Solà-Valls N, Llufriu S, Blanco Y, de Seze J, Vukusic S, Saiz A, Marignier R.
J Neurol. 2019 Apr;266(4):816. doi: 10.1007/s00415-019-09215-1.
Neurological Involvement in Childhood Evans Syndrome.
Pincez T, Neven B, Le Pointe HD, Varlet P, Fernandes H, Gareton A, Leverger G, Leblanc T, Chambost H, Michel G, Pasquet M, Millot F, Hermine O, Mathian A, Hully M, Zephir H, Hamidou M, Durand JM, Perel Y, Landman-Parker J, Rieux-Laucat F, Aladjidi N.
J Clin Immunol. 2019 Feb;39(2):171-181. doi: 10.1007/s10875-019-0594-3.
Usefulness of MOG-antibody titres at first episode to predict the future clinical course in adults.
Cobo-Calvo A, Sepúlveda M, d'Indy H, Armangué T, Ruiz A, Maillart E, Papeix C, Audoin B, Zephir H, Biotti D, Ciron J, Durand-Dubief F, Collongues N, Ayrignac X, Labauge P, Thouvenot E, Montcuquet A, Deschamps R, Solà-Valls N, Llufriu S, Blanco Y, de Seze J, Vukusic S, Saiz A, Marignier R; OFSEP Group; REEM Group .
J Neurol. 2019 Apr;266(4):806-815. doi: 10.1007/s00415-018-9160-9.
2018
Myelination induction by a histamine H3 receptor antagonist in a mouse model of preterm white matter injury.
Rangon CM, Schang AL, Van Steenwinckel J, Schwendimann L, Lebon S, Fu T, Chen L, Beneton V, Journiac N, Young-Ten P, Bourgeois T, Maze J, Matrot B, Baburamani AA, Supramaniam V, Mallard C, Trottet L, Edwards AD, Hagberg H, Fleiss B, Li J, Chuang TT, Gressens P.
Brain Behav Immun. 2018 Nov;74:265-276. doi: 10.1016/j.bbi.2018.09.017.
Optic nerve double inversion recovery hypersignal in patients with clinically isolated syndrome is associated with asymptomatic gadolinium-enhanced lesion.
London F, Zéphir H, Hadhoum N, Lannoy J, Vermersch P, Pruvo JP, Hodel J, Leclerc X, Outteryck O.
Mult Scler. 2019 Dec;25(14):1888-1895. doi: 10.1177/1352458518815797.
Evaluation of no evidence of progression or active disease (NEPAD) in patients with primary progressive multiple sclerosis in the ORATORIO trial.
Wolinsky JS, Montalban X, Hauser SL, Giovannoni G, Vermersch P, Bernasconi C, Deol-Bhullar G, Garren H, Chin P, Belachew S, Kappos L.
Ann Neurol. 2018 Oct;84(4):527-536. doi: 10.1002/ana.25313.
Efficacy of Cladribine Tablets in high disease activity subgroups of patients with relapsing multiple sclerosis: A post hoc analysis of the CLARITY study.
Giovannoni G, Soelberg Sorensen P, Cook S, Rammohan KW, Rieckmann P, Comi G, Dangond F, Hicking C, Vermersch P.
Mult Scler. 2019 May;25(6):819-827. doi: 10.1177/1352458518771875.
OFSEP and NOMADMUS Study Group. Clinical spectrum and prognostic value of CNS MOG autoimmunity in adults: The MOGADOR study.
Cobo-Calvo A, Ruiz A, Maillart E, Audoin B, Zephir H, Bourre B, Ciron J, Collongues N, Brassat D, Cotton F, Papeix C, Durand-Dubief F, Laplaud D, Deschamps R, Cohen M, Biotti D, Ayrignac X, Tilikete C, Thouvenot E, Brochet B, Dulau C, Moreau T, Tourbah A, Lebranchu P, Michel L, Lebrun-Frenay C, Montcuquet A, Mathey G, Debouverie M, Pelletier J, Labauge P, Derache N, Coustans M, Rollot F, De Seze J, Vukusic S, Marignier R;
Neurology. 2018 May 22;90(21):e1858-e1869. doi: 10.1212/WNL.0000000000005560.
Siponimod versus placebo in secondary progressive multiple sclerosis (EXPAND): a double-blind, randomised, phase 3 study.
Kappos L, Bar-Or A, Cree BAC, Fox RJ, Giovannoni G, Gold R, Vermersch P, Arnold DL, Arnould S, Scherz T, Wolf C, Wallström E, Dahlke F; EXPAND Clinical Investigators.
Lancet. 2018 Mar 31;391(10127):1263-1273. doi: 10.1016/S0140-6736(18)30475-6.
Magnetic resonance imaging changes following natalizumab discontinuation in multiple sclerosis patients with progressive multifocal leukoencephalopathy.
Hodel J, Bapst B, Outteryck O, Verclytte S, Deramecourt V, Benadjaoud MA, Pruvo JP, Vermersch P, Leclerc X.
Mult Scler. 2018 Dec;24(14):1902-1908. doi: 10.1177/1352458517750765.
2017
Thymic-Specific Serine Protease Limits Central Tolerance and Exacerbates Experimental Autoimmune Encephalomyelitis.
Serre L, Girard M, Ramadan A, Menut P, Rouquié N, Lucca LE, Mahiddine K, Leobon B, Mars LT, Guerder S;
J Immunol. 2017 Dec 1;199(11):3748-3756. doi: 10.4049/jimmunol.1700667.
Dynamic Expression Patterns of Progenitor and Neuron Layer Markers in the Developing Human Dentate Gyrus and Fimbria.
Cipriani S, Journiac N, Nardelli J, Verney C, Delezoide AL, Guimiot F, Gressens P, Adle Biassette H.
Cereb Cortex. 2017 Jan 1;27(1):358-372. doi: 10.1093/cercor/bhv223.
Proinflammatory B-cell profile in the early phases of MS predicts an active disease.
Thomas Guerrier, Myriam Labalette, David Launay, Catalina Lee-Chang , Olivier Outteryck , Guillaume Lefèvre, Vermersch P, Dubucquoi S, Zéphir H.
Neurol Neuroimmunol Neuroinflamm. 2017 Dec 22;5(2):e431. doi: 10.1212/NXI.0000000000000431.
A comparison of multiple sclerosis disease activity after discontinuation of fingolimod and placebo.
Vermersch P, Radue EW, Putzki N, Ritter S, Merschhemke M, Freedman MS.
Mult Scler J Exp Transl Clin. 2017 Sep 27;3(3):2055217317730096. doi: 10.1177/2055217317730096.
Safety and efficacy of cladribine tablets in patients with relapsing-remitting multiple sclerosis: Results from the randomized extension trial of the CLARITY study.
Giovannoni G, Soelberg Sorensen P, Cook S, Rammohan K, Rieckmann P, Comi G, Dangond F, Adeniji AK, Vermersch P.
Mult Scler. 2018 Oct;24(12):1594-1604. doi: 10.1177/1352458517727603.
Synthesis and pharmacological evaluation of benzamide derivatives as potent and selective sigma-1 protein ligands.
Donnier-Maréchal M, Carato P, Larchanché PE, Ravez S, Boulahjar R, Barczyk A, Oxombre B, Vermersch P, Melnyk P.
Eur J Med Chem. 2017 Sep 29;138:964-978. doi: 10.1016/j.ejmech.2017.07.014.
Biomarkers and Response to Natalizumab for Multiple Sclerosis Treatment (BIONAT), Best EScalation Treatment in Multiple Sclerosis (BEST-MS), and the Société Francophone de la Sclérose En Plaques (SFSEP) Network. Matrix metalloproteinase 9 is decreased in natalizumab-treated multiple sclerosis patients at risk for progressive multifocal leukoencephalopathy.
Fissolo N, Pignolet B, Matute-Blanch C, Triviño JC, Miró B, Mota M, Perez- Hoyos S, Sanchez A, Vermersch P, Ruet A, de Sèze J, Labauge P, Vukusic S, Papeix C, Almoyna L, Tourbah A, Clavelou P, Moreau T, Pelletier J, Lebrun-Frenay C, Montalban X, Brassat D, Comabella M;
Ann Neurol. 2017 Aug;82(2):186-195. doi: 10.1002/ana.24987.
Revues
Indications de l’autogreffe dans la sclérose en plaques : recommandations de la Société francophone de greffe de moelle et de thérapie cellulaire (SFGM-TC) en lien avec la Société francophone de la sclérose en plaques [Indications and follow-up for autologous hematopoietic stem cell transplantation in multiple sclerosis: Guidelines from the Francophone Society of Bone Marrow Transplantation and Cellular Therapy (SFGM-TC) in association with the Francophone Society of Multiple Sclerosis].
Zephir H, Puyade M, Gueguen A, Michel L, Terriou L, Dive D, Laureys G, Mathey G, Labauge P, Marjanovic Z, Pugnet G, Badoglio M, Lansiaux P, Yakoub-Agha I, Béguin Y, Farge D.
Bull Cancer. 2019, Jan;106(1S):S92-S101. French. doi: 10.1016/j.bulcan.2018.11.002.
Knowledge Is Power, but Is Ignorance Bliss? Optimising Conversations About Disease Progression in Multiple Sclerosis.
Vermersch P, Shanahan J, Langdon D, Yeandle D, Alexandri N, Schippling S.
Neurol Ther. 2020 Jun;9(1):1-10. doi: 10.1007/s40120-019-00170-7.
Unmet needs, burden of treatment, and patient engagement in multiple sclerosis: A combined perspective from the MS in the 21st Century Steering Group.
Members of the MS in the 21st Century Steering Group:, Rieckmann P, Centonze D, Elovaara I, Giovannoni G, Havrdová E, Kesselring J, Kobelt G, Langdon D, Morrow SA, Oreja-Guevara C, Schippling S, Thalheim C, Thompson H, Vermersch P, Aston K, Bauer B, Demory C, Giambastiani MP, Hlavacova J, Nouvet-Gire J, Pepper G, Pontaga M, Rogan E, Rogalski C, van Galen P, Ben-Amor AF.
Mult Scler Relat Disord. 2018 Jan;19:153-160. doi: 10.1016/j.msard.2017.11.013.

