Développementet plasticité du cerveau neuroendocrine

Présentation de l'équipe
Localisé sur le campus du CHU de Lille, notre laboratoire a pour principal objectif de décrypter le dialogue complexe qui s’opère entre le cerveau et la périphérie : le rôle joué par l’hypothalamus dans le contrôle du métabolisme et de la reproduction, et les conséquences d’une dérégulation de ce dialogue sur l’homéostasie de l’organisme, les fonctions cognitives et le vieillissement du cerveau. Notre laboratoire a une dimension internationale, réunissant les compétences de neuroscientifiques et de médecins spécialisés dans les troubles reproductifs et métaboliques et en neurochirurgie. Nous travaillons en collaboration permanente avec de nombreuses équipes de recherche dans le monde entier.
À LA UNE
Vincent Prévot, Président de Commission scientifique FNRS et Directeur de recherches à l’INSERM, « à propos de la liberté de chercher et de l’importance de l’expérimentation animale pour la recherche scientifique« , Soirée fondamentale du FNRS, 25 octobre 2023
Un rêve de science qui se poursuit: Q&R avec Vincent Prevot, PhD
Vincent Prévot, lauréat du Grand Prix 2023 de la Fondation pour la Recherche Médicale
Grand Prix Scientifique 2023 de la Fondation NRJ Institut de France décerné à Vincent Prévot

Lire l’article
La nouvelle thérapie qui pourrait changer la vie d’Eliaou
Le monoxyde d’azote ouvre de nouvelles pistes pour réduire les complications à long terme, comme un risque plus élevé de souffrir de troubles cognitifs et sensoriels mais aussi dʹinfertilité à lʹâge adulte, chez les enfants nés prématurés. Cʹest ce que révèle une étude française avec la participation de la Suisse et de la Grèce.
Un traitement améliore les capacités cognitives des porteurs de trisomie 21
Portrait d’Inserm
Adrian Coutteau Robles
Une “mini puberté”
chez les bébés ?

Le projet miniNO pourrait bien soulager des dizaines de millions de vies.
Podcast disponible sur Euroradio ou en direct sur Sound Cloud

Laurine Decoster obtient le 1er prix du public
Le projet WATCH élu « success story » par la Commission Européenne.
Neural mechanism facilitates
network integration for fertility-controlling neurons and sexual maturation.
Comment le Covid s’attaque au cerveau.
Des chercheurs européens pensent avoir mis au jour le mécanisme par lequel le virus détruirait les parois des vaisseaux sanguins qui irriguent les neurones, ce qui expliquerait certains troubles neurologiques.
LE FIGARO mercredi 17 novembre 2021
(Lire l’article)



SALLE DE PRESSE
Trisomie 21 : Une hormone ouvre des pistes de traitement inédites
Trisomie 21 : Un traitement encourageant.
KISSPETINE, l’autre nom de l’amour.
« La Voix du Nord » (13 Mars 2022)
Des chercheurs traquent les effets du Covid sur la fertilité et le vieillissement

« Les Echos » (13 Septembre 2021)
Nouvelles lumières sur le diabète
Inserm Actualités (02 Août 2021)
Diabète : nouvelles avancées de la recherche grâce à l’étude du mécanisme de satiété
Inserm Actualités (08 fév 2021) Transmission du SOPK de mère en fille : l’épigénétique en cause |



À REGARDER
Trisomie 21, un espoir de traitement.
Le Mag de la Santé.
Une thérapie améliore les fonctions cognitives
Prix jeune talent décerné à Nour El Houda Mimouni par la fondation l’Oréal et l’UNESCO pour les femmes et la science.
Le nez, porte d’entrée du Covid : quels dangers dans le développement neuronal de l’enfant? FDS 2021
Défi Santé « Le Projet VERTEXA »
Et si bien vieillir dépendait de la porte d’entrée des hormones dans le cerveau?
Projet WATCH pour Well-Aging and the Tanycytic Control of Health.
Sensation de satiété : chronique de Thierry Lhermitte
Vincent Prevot présente son colloque « Les tanycytes hypothalamiques en régulation métabolique ».
PRIX
Scientifiques
Anorexie mentale « Le Projet VERTEXA », obtient 2 prix en 2020
- PERSONNEL
- THÈMES DE RECHERCHE
- PRODUCTIONS SCIENTIFIQUES
Responsables de projets
 | DIRECTEUR DU LABORATOIRE Dr. Vincent Prévot, Ph.D. La recherche de Vincent Prevot se concentre sur les neurosciences systémiques et la neuroendocrinologie, en particulier les circuits cérébraux qui contrôlent la reproduction et le métabolisme et les voies neurales par lesquelles ils répondent aux informations périphériques. |
 | Dr. Paolo Giacobini, Ph.D. Expert en neurosciences du développement et migration neuronale. |
 | Dr. Sébastien Bouret, Ph.D. Expert en neuroendocrinologie de l’obésité. Les recherches menées par Sébastien s’intéressent à étudier le role de l’environnement périnatal et les mécanismes neurodéveloppementaux influençant l’obésité et le métabolisme tout au long de la vie.En savoir plus sur le travail de Sébastien |
 | Dr Virginie Mattot, Ph.D. Expertise en biologie vasculaire (angiogenèse, activation de l’endothélium, fonctions et propriétés des cellules endothéliales,) et en matrice extracellulaire vasculaire. |
 | Dr Alicia Mayeuf-Louchart, Ph.D. |
 | Dr. Ines Martinez Corral, Ph.D. |
 | |
 | |
 | Dr. Marc Baroncini, M.D, Ph.D. Marc est neurochirurgien, praticien hospitalier au CHU de Lille. Il s’intéresse à l’anatomie de l’hypothalamus, au contrôle hypothalamique du métabolisme et à a dérégulation dans les troubles du comportement alimentaire. Il s’occupe également de la pathologie chirurgicale du liquide cérébrospinal. |
 | Dr Vincent Florent, M.D, Ph.D. Vincent est un médecin hospitalier spécialiste en nutrition clinique, métabolisme et troubles alimentaires. Il est à l’origine de plusieurs études translationnelles notamment sur l’étude de la communication de l’hypothalamus avec la périphérie chez l’Homme. Il a conçu un programme innovant de jeu thérapeutique en réalité virtuelle dénommé VERTEXA, visant à soigner les troubles alimentaires. |
Coordinateurs scientifiques de Projets Européens
 | |
 |
Partenaires cliniques
 | Dr. Sophie Catteau-Jonard, PU-PH, M.D, Ph.D.
Principaux thèmes de recherche : troubles de l’ovulation tels que le syndrome des ovaires polykystiques, l’aménorrhée hypothalamique, l’hypogonadisme hypogonadotrope et l’insuffisance ovarienne prématurée. |
 | Pr. Claude-Alain Maurage, M.D., Ph.D. |
 | Dr. Anne-Laure Barbotin, M.D, Ph.D.
|
Ingénieures
 | Dr. Cécile Allet, Ph.D. Formation : Thèse de doctorat de l’Université de Lille « Gliogenèse dans l‘hypothalamus au cours du développement post-natal : implication dans le contrôle de la maturation sexuelle femelle ». |
 | Dr. Émilie Caron, Ph.D. Formation : Thèse de doctorat de l’Université de Lille 2 « Leptine et régulation hypothalamique de la fonction de reproduction chez la souris » 2006. Master recherche en Neurosciences, Université de Lille 2, 2003. |
 | Sarah Gallet
Impact de la mélatonine sur la barrière hémato-encéphalique au niveau de l’éminence médiane. Formation : Master de Biologie et Biotechnologies, Université de Lille 1, 2011. |
 | Manon Leclerc |
 | Shengyue Deng |
 | Maxime Delit |
Assistants Ingénieurs
 | Danielle Mazur
|
 | Amandine Legrand
|
Post Docs
 | Dr. Betty Rodriguez-Cortez, Ph.D |
 | Dr. Daniela Fernandois Ph.D |
 | Dr. Sreekala Nampoothiri, Ph.D |
 | Dr. Ludovica Cotellessa, Ph.D
|
 | Dr. Marialetizia Rastelli, Ph.D
|
 | Dr. Gaetan Ternier, Ph.D
|
 | Dr. Florent Sauvé, Ph.D
|
 | Dr. Sooraj NAIR D.M.V, Ph.D |
 | Virginia Delli
|
Doctorants
 | Eleonora Deligia
|
 | Rémi Kurdian
|
 | Mouna Accary
|
 | Amine Bouchekioua |
 | Fatima Timzoura
|
 | Pierre-Yves Barelle
|
 | Ophélie Hannot
|
 | Alicia Sicardi
|
 | Nabil Nasri
|
 | Amine Belfoul
|
 | Claire Jasinki |
 | Mathilde Roux |
 | Rachel Spenle |
 | Ricardo Martinez-Gomez |
 | Sixtine Karmann |
 | Loïc Kacimi |
 | Charles-Antoine Seux |
Alumni
 | Laurine Decoster, PhD |
 | Caio Coelho, PhD |
 | Dr. Laura Kuczynski, PhD |
 | Dr. Monica Imbernon, Ph.D |
 | Dr. Adrian Coutteau Robles; Ph.D |
 | Dr. Nour El Houda Mimouni, Ph.D |
 | Dr. Mauro Silva, Ph.D |
 | Dr. Marion Martin, Ph.D |
 | Dr. Maëliss Peigné, M. D., Ph.D |
 | Dr. Manon Duquenne, Ph.D
|
 | Dr. Sophie Crozier, Ph.D Group Leader at the UNIL, Lausanne, Switzerland https://www.unil.ch/cig/en/home/menuinst/research/dr-sophie-croizier.html |
 | Dr. Valerie Leysen |
 | Dr. Charlotte Vanacker, Ph.D |
 | Dr. Irène Cimino, Ph.D |
 | Dr. Mathieu Méquinion, Ph.D Post Doctoral Fellow, University of Monash, Zane Lab, Australia. |
 | Dr. Gustav Colldén, Ph.D |
 | Dr. Jyoti Parkash, Ph.D |
 | Dr. Andrea Messina, Ph.D |
 | Dr. Filippo Casoni, Ph.D |
 | Dr. Julien Mallard, Ph.D |
 | Dr. Fanny Langlet, Ph.D
|
 | Dr. Églantine Balland, Ph.D |
 | Dr. Naresh Hanchate, Ph.D |
 | Dr. Nicole Bellefontaine, Ph.D |
 | Dr. Sophie Steculorum, Ph.D
|
 | Dr. Xavier d’Anglemont de Tassigny, Ph.D |
 | Dr. Amandine Mullier, Ph.D |
 | Dr. Sara Trova, Ph.D |
 | Dr. Giuliana Pellegrino, Ph.D |
 | Dr. Samuel Malone, Ph.D |
 | Dr. Sonal Shruti, Ph.D |
 | Dr. Jérôme Clasadonte, Ph.D |
 | Dr. Maria Manfredi Lozano, Ph.D |
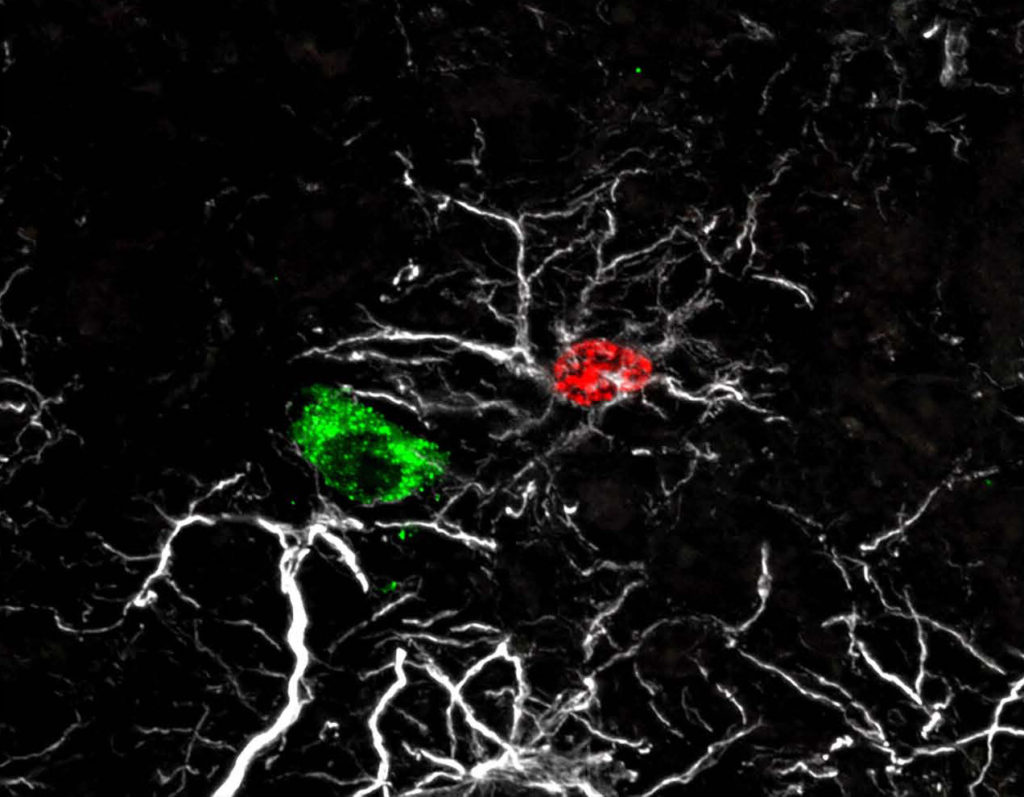
Il est maintenant de plus en plus reconnu que les interactions entre les systèmes hypothalamiques neuroendocrines et les hormones périphériques jouent un rôle crucial dans le développement cérébral post-natal et que leur dérégulation peut-être à l’origine de troubles neurologiques et psychiatriques majeurs. De plus, des travaux menés au cours des dernières années ont montré l’implication de déséquilibres neurohormonaux centraux dans la pathophysiologie de troubles cognitifs, tels que certaines démences précoces, et de désordres métaboliques et reproductifs tels que l’obésité et l’infertilité. Notre laboratoire étudie l’impact de facteurs chimiotropes et d’hormones périphériques (estrogènes, leptine, hormone anti-müllérienne…) sur le développement et le fonctionnement de l’hypothalamus, ainsi que l’importance fonctionnelle des cellules non-neuronales (tanycytes, astrocytes et cellules endothéliales) dans le dialogue entre la périphérie et le système nerveux central.
Nous évaluons également dans quelle mesure des situations pathologiques (obésité, diabète etc.) affectent ces processus neurobiologiques et, à l’inverse, comment un défaut de communication entre le cerveau et la périphérie sensibilise l’organisme à de telles pathologies (obésité, diabète, puberté précoce ou retardée, infertilité). Notre laboratoire réunit en un site unique un large éventail de compétences théoriques et techniques dans son domaine de recherche et est en mesure d’explorer des processus physiologiques et pathologiques de l’échelle moléculaire et génétique/épigénétique à celle du patient, grâce à des interactions étroites entre chercheurs scientifiques et cliniciens. Pour l’excellence de ses recherches, notre laboratoire a été classé « remarquable » (la plus haute distinction attribuée aux laboratoires de recherche français) par les instances d’évaluation en 2014 et 2019.
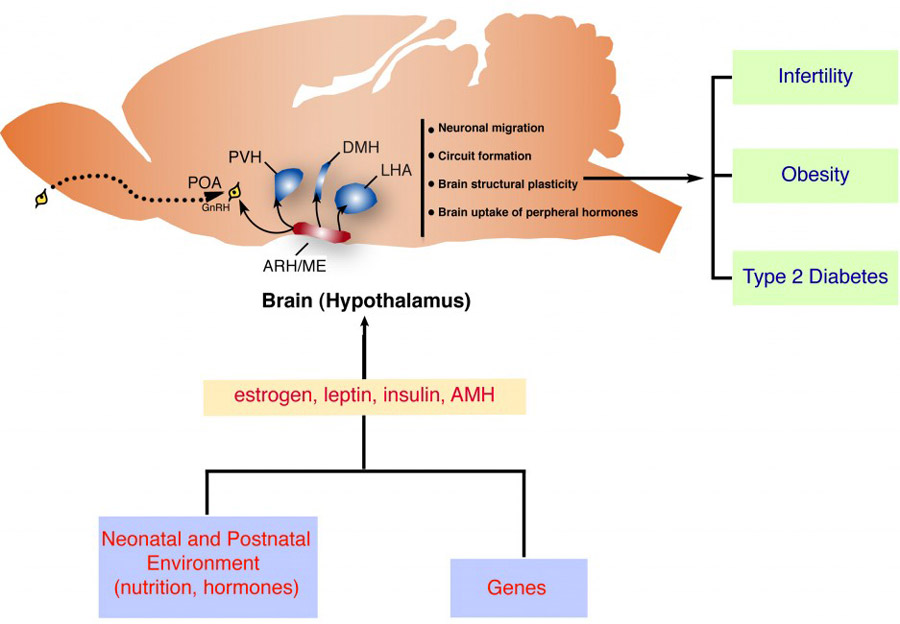
Abréviations : ARH/me : noyau arqué de l’hypothalamus/éminence médiane ; GnRH : gonadotropin releasing hormone ; POA : région préoptique ; PVH : noyau périventriculaire de l’hypothalamus ; DMH : noyau dorsomédian de l’hypothalamus ; LHA : aire hypothalamique latérale ; AMH : hormone anti-müllérienne.
Notre laboratoire est aussi activement impliqué dans différents réseaux de recherche locaux (FHU 1000 jours pour la Santé, DN2M), nationaux (Société de Neuroendocrinologie (SNE), GDR repro, Société des neurosciences (http://www.neurosciences.asso.fr), Club de cellules gliales) et internationaux (LARC-Neurosciences, GnRH network, FENS).
Articles originaux
2023
Hypothalamic neuroglial plasticity is regulated by anti-Müllerian hormone and disrupted in polycystic ovary syndrome.
Barbotin AL, Mimouni NEH, Kuchcinski G, Lopes R, Viard R, Rasika S, Mazur D, Silva MSB, Simon V, Boursier A, Pruvo JP, Yu Q, Candlish M, Boehm U, Bello FD, Medana C, Pigny P, Dewailly D, Prevot V, Catteau-Jonard S, Giacobini P.
EBioMedicine. 2023;90:104535. doi: 10.1016/j.ebiom.2023.104535PMID: 37001236
Overactivation of GnRH neurons is sufficient to trigger polycystic ovary syndrome-like traits in female mice.
Silva MSB, Decoster L, Delpouve G, Lhomme T, Ternier G, Prevot V, Giacobini P.
EBioMedicine. 2023;97:104850. doi: 10.1016/j.ebiom.2023.104850.PMID: 37898094
Maternal low-calorie sweetener consumption rewires hypothalamic melanocortin circuits via a gut microbial co-metabolite pathway.
Park S, Belfoul AM, Rastelli M, Jang A, Monnoye M, Bae H, Kamitakahara A, Giavalisco P, Sun S, Barelle PY, Plows J, Jang C, Fodor A, Goran MI, Bouret SG.
JCI Insight. 2023;8(10):e156397. doi: 10.1172/jci.insight.156397.PMID: 37014702
Long-COVID cognitive impairments and reproductive hormone deficits in men may stem from GnRH neuronal death.
Sauve F, Nampoothiri S, Clarke SA, Fernandois D, Ferreira Coêlho CF, Dewisme J, Mills EG, Ternier G, Cotellessa L, Iglesias-Garcia C, Mueller-Fielitz H, Lebouvier T, Perbet R, Florent V, Baroncini M, Sharif A, Ereño-Orbea J, Mercado-Gómez M, Palazon A, Mattot V, Pasquier F, Catteau-Jonard S, Martinez-Chantar M, Hrabovszky E, Jourdain M, Deplanque D, Morelli A, Guarnieri G, Storme L, Robil C, Trottein F, Nogueiras R, Schwaninger M, Pigny P, Poissy J, Chachlaki K, Maurage CA, Giacobini P, Dhillo W, Rasika S, Prevot V.
EBioMedicine. 2023;96:104784. doi: 10.1016/j.ebiom.2023.104784. PMID: 37713808
Protocol for simultaneous patch-clamp recording from tanycytes and neurons in living mouse brain slices.
Lhomme T, Prévot V.
STAR Protoc. 2023 20;4(4):102571. doi: 10.1016/j.xpro.2023.102571. PMID: 37733593
COVID-19 could worsen cerebral amyloid angiopathy.
Dewisme J, Lebouvier T, Vannod-Michel Q; Lille COVID Research Network (LICORNE); Prevot V, Maurage CA.
J Neuropathol Exp Neurol. 2023 21;82(9):814-817. doi: 10.1093/jnen/nlad049.PMID: 37428895
Cell proliferation and glial cell marker expression in the wall of the third ventricle in the tuberal region of the male mouse hypothalamus during postnatal development.
Coutteau-Robles A, Prevot V, Sharif A.
J Neuroendocrinol. 2023;35(3):e13239. doi: 10.1111/jne.13239. PMID: 36863859
Male minipuberty involves the gonad-independent activation of preoptic nNOS neurons.
Delli V, Dehame J, Franssen D, Rasika S, Parent AS, Prevot V, Chachlaki K.
Free Radic Biol Med. 2023 Jan;194:199-208. doi: 10.1016/j.freeradbiomed.2022.11.040. PMID: 36470319
2022
NOS1 mutations cause hypogonadotropic hypogonadism with sensory and cognitive deficits that can be reversed in infantile mice.
Female sexual behavior is disrupted in a preclinical mouse model of PCOS via an attenuated hypothalamic nitric oxide pathway.
Tanycytes control hypothalamic liraglutide uptake and its anti-obesity actions.
Melatonin drugs inhibit SARS-CoV-2 entry into the brain and virus-induced damage of cerebral small vessels.
Int J Obes (Lond). 2022 Feb 16. doi: 10.1038/s41366-022-01093-4.
2021
The SARS-CoV-2 main protease Mpro causes microvascular brain pathology by cleaving NEMO in brain endothelial cells.
Nat Neurosci. 2021 Nov;24(11):1522-1533.
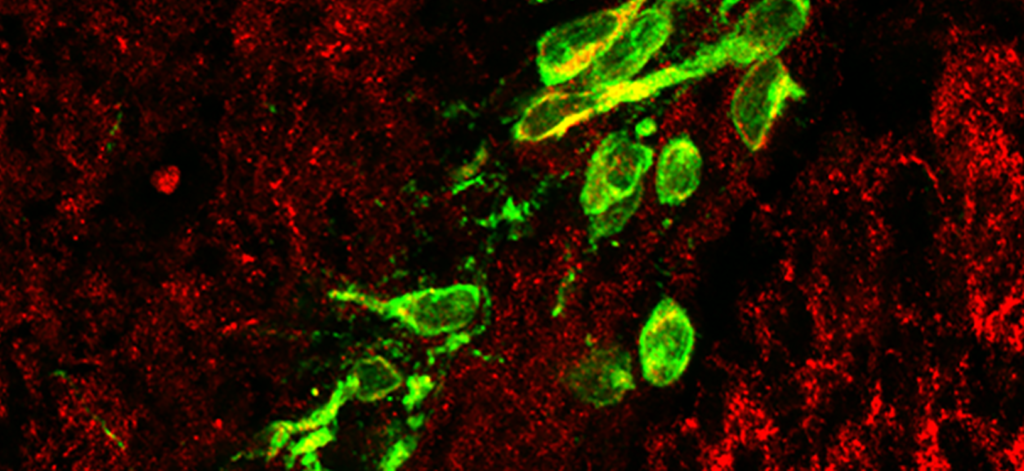
GnRH neurons recruit astrocytes in infancy to facilitate network integration and sexual maturation.
Nat Neurosci. 2021 Dec;24(12):1660-1672.
Leptin brain entry via a tanycytic LepR-EGFR shuttle controls lipid metabolism and pancreas function.
Duquenne M, Folgueira C, Bourouh C, Millet M, Silva A, Clasadonte J, Imbernon M, Fernandois D, Martinez-Corral I, Kusumakshi S, Caron E, Rasika S, Deliglia E, Jouy N, Oishi A, Mazzone M, Trinquet E, Tavernier J, Kim YB, Ory S, Jockers, R., Schwaninger, M., Boehm, U., Nogueiras, R., Annicotte, J.S., Gasman, S., Dam, J. & Prevot, V.
Nat Metab 2021. 3: 1071-1090
Tanycytic networks mediate energy balance by feeding lactate to glucose-insensitive POMC neurons.
Lhomme T, Clasadonte J, Imbernon M, Fernandois D, Sauve F, Caron E, Lima N, Heras V, Martinez-Corral I, Muller-Fielitz H, Rasika S, Schwaninger M, Nogueiras R, Prevot V.
J Clin Invest 2021. 131:e140521.10.1172/JCI140521
Mutations in SEMA3F and PLXNA3 Encoding Semaphorin-3F and its Receptor Plexin-A3 Respectively Cause Idiopathic Hypogonadotropic Hypogonadism.
Kotan, L.D., Ternier, G., Cakir, A.D., Emeksiz, H.C., Turan, I., Delpouve, G., Kardelen, A.D., Ozcabi, B., Isik, E., Mengen, E., Cakir, E.D.P., Yuksel, A., Agladioglu, S.Y., Dilek, S.O., Evliyaoglu, O., Darendeliler, F., Gurbuz, F., Akkus, G., Yuksel, B., Giacobini, P. & Topaloglu, A.K. (2021) Loss-of-Function Genetics in Medicine.
Genet Med 2021. 23/1008-1016. DOI: 10.1038/s41436-020-01087-5
Polycystic ovary syndrome is transmitted via a transgenerational epigenetic process.
Mimouni NEH, Paiva I, Barbotin AL, Timzoura FE, Plassard D, Le Gras S, Ternier G, Pigny P, Catteau-Jonard S, Simon V, Prevot V, Boutillier AL, Giacobini P (2021) Polycystic ovary syndrome is transmitted via a transgenerational epigenetic process. Cell Metab 33:513-530.e8 DOI: 10.1016/j.cmet.2021.01.004
2020
The proportion of cleaved anti-Müllerian hormone is higher in serum but not follicular fluid of obese women independently of polycystic ovary syndrome.
DOI: Peigné M., Pigny1 P., Pankhurst M.W., Drumez E., Loyens A., Dewailly D., Catteau-Jonard S., Giacobini P.
Reproductive BioMedicine Online 2020 , 41:1112-1121. DOI: 10.1016/j.rbmo.2020.07.020.
Neuron-Derived Neurotrophic Factor Is Mutated in Congenital Hypogonadotropic Hypogonadism.
Messina A, Pulli K, Santini S, Acierno J, Känsäkoski J, Cassatella D, Xu C, Casoni F, Malone SA, Ternier G, Conte D, Sidis Y, Tommiska J, Vaaralahti K, Dwyer A, Gothilf Y, Merlo GR, Santoni F, Niederländer NJ, Giacobini P*, Raivio T*, Pitteloud N*
Am J Hum Genet. 2020, 106:58-70.* Equal contribution.
Neuropilin-1 expression in GnRH neurons regulates prepubertal weight gain and sexual attraction.
Vanacker C, Trova S, Shruti S, Casoni F, Messina A, Croizier S, Malone S, Ternier G, Hanchate NK, Bouret SG, Ciofi P, Giacobini P, Prevot V
Embo J 2020. 39, e104633
The endoplasmic reticulum stress-autophagy pathway controls hypothalamic development and energy balance regulation in leptin-deficient neonates.
Park S, Aintablian A, Coupe B, Bouret SG
Nat Commun 2020. 11, 1914
Maternal obesity-induced endoplasmic reticulum stress causes metabolic alterations and abnormal hypothalamic development in the offspring.
Park S, Jang A, Bouret SG
PLoS Biol 2020. 18, e3000296
Hypothalamic Structural and Functional Imbalances in Anorexia Nervosa.
Florent V, Baroncini M, Jissendi-Tchofo P, Lopes R, Vanhoutte M, Rasika S, Pruvo JP, Vignau J, Verdun S, Johansen JE, Pigeyre M, Bouret SG, Nilsson IAK, Prevot V.
Neuroendocrinology. 2020. 110, 552-562.
2019
Human Semaphorin 3 Variants Link Melanocortin Circuit Development and Energy Balance.
Van der Klaauw AA, Croizier S, Mendes de Oliveira E, Stadler LKJ, Park S, Kong Y, Banton MC, Tandon P, Hendricks AE, Keogh JM, Riley SE, Papadia S, Henning E, Bounds R, Bochukova EG, Mistry V, O'Rahilly S, Simerly RB, Consortium UK, , Minchin, J.E.N., Barroso, I., Jones, E.Y., Bouret, S.G. & Farooqi, I.S.
Cell 2019. 176: 729-742 e18
Non-nutritive Sweeteners Induce Hypothalamic ER Stress Causing Abnormal Axon Outgrowth.
Park, S., Sethi, S. & Bouret, S.G.
Front Endocrinol (Lausanne) 2019. 10, 876.
Defective AMH signaling disrupts GnRH neuron development and function and contributes to hypogonadotropic hypogonadism.
Malone, S.A., Papadakis, G.E., Messina, A., Mimouni, N.E.H., Trova, S., Imbernon, M., Allet, C., Cimino, I., Acierno, J., Cassatella, D., Xu, C., Quinton, R., Szinnai, G., Pigny, P., Alonso-Cotchico, L., Masgrau, L., Marechal, J.D., Prevot, V., Pitteloud, N. & Giacobini, P.
Elife 2019. 8: e47198. doi: 10.7554/eLife.47198
2018
Central Dicer-miR-103/107 controls developmental switch of POMC progenitors into NPY neurons and impacts glucose homeostasis.
Croizier, S., Park, S., Maillard, J. & Bouret, S.G.
Elife 2018. 7: e40429
Elevated prenatal anti-Müllerian hormone reprograms the fetus and induces polycystic ovary syndrome in adulthood
Tata B, Mimouni NEH, Barbotin AL, Malone SA, Loyens A, Pigny P, Dewailly D, Catteau-Jonard S, Sundström-Poromaa I, Piltonen TT, Dal Bello F, Medana C, Prevot V, Clasadonte J, Giacobini P.
Nat Med. 2018. doi: 10.1038/s41591-018-0035-5.
A comparative study of the neural stem cell niche in the adult hypothalamus of human, mouse, rat and grey mouse lemur (Microcebus murinus)
Pellegrino G, Trubert C, Terrien J, Pifferi F, Leroy D, Loyens A, Migaud M, Baronicini M, Maurage CA, Fontaine C, Prevot V, Sharif A
J Comp Neurol. 2018. 526(9):1419-1443
2017
Connexin 43-Mediated Astroglial Metabolic Networks Contribute to the Regulation of the Sleep-Wake Cycle
Clasadonte, J., E. Scemes, Z. Wang, D. Boison, and P.G. Haydon.
Neuron. 2017. 95:1365-1380.e5.
Phenotyping of nNOS Neurons in the Postnatal and Adult Female Mouse Hypothalamus
Chachlaki K, Malone SA, Qualls-Creekmore, Hrabovszky E, Munzberg H, Giacobini P, Ango F, Prevot V
J Comp Neurol, 2017. 525:3177-3189
Tridimensional Visualization and Analysis of Early Human Development
Belle M, Godefroy D, Couly G, Malone SA, Collier F, Giacobini P, Chedotal A
Cell. 2017. 169:161-173 e112
Revues
2023
New Horizons: Gonadotropin-Releasing Hormone and Cognition.
Prévot V, Tena-Sempere M, Pitteloud N.
J Clin Endocrinol Metab. 2023;108(11):2747-2758. doi: 10.1210/clinem/dgad319.PMID: 37261390 Review.
Food odour recognition adjusts systemic metabolism to nutrient availability.
Prevot V, Nogueiras R.
Nat Rev Endocrinol. 2023;19(3):130-131. doi: 10.1038/s41574-022-00801-4.PMID: 36599948 No abstract available.
2022
Glial cells as integrators of peripheral and central signals in the regulation of energy homeostasis.
Sowing SARS-CoV-2 to reap neurodegeneration: A hamster study.
The polygamous GnRH neuron: Astrocytic and tanycytic communication with a neuroendocrine neuronal population.
Glycemic control: Tanycytes march to the beat of the suprachiasmatic drummer.
Glial control of neuronal function.
Developmental programming of hypothalamic melanocortin circuits.
Molecular control of the development of hypothalamic neurons involved in metabolic regulation.
2021
Neurogenesis in the adult hypothalamus: A distinct form of structural plasticity involved in metabolic and circadian regulation, with potential relevance for human pathophysiology Sharif A, Fitzsimons CP, Lucassen PJ. Handb Clin Neurol. 2021;179:125-140.
Tanycytes in the infundibular nucleus and median eminence and their role in the blood-brain barrier.
Prevot, V., Nogueiras, R. & Schwaninger, M.
Handb Clin Neurol 2021, 180: 253-273.
The KiNG of reproduction: Kisspeptin/ nNOS interactions shaping hypothalamic GnRH release.
Delli, V., Silva, M.S.B., Prevot, V. & Chachlaki, K.
Mol Cell Endocrinol 2021, 532:111302.
New insights into anti-Mullerian hormone role in the hypothalamic-pituitary-gonadal axis and neuroendocrine development.
Silva, M.S.B. & Giacobini, P.
Cell Mol Life Sci. 2021, 78:1-16. DOI: 10.1007/s00018-020-03576-x.78: 1-16.
A roadmap for the Human Developmental Cell Atlas.
Haniffa, M., Taylor, D., Linnarsson, S., Aronow, B.J., Bader, G.D., Barker, R.A., Camara, P.G., Camp, J.G., Chedotal, A., Copp, A., Etchevers, H.C., Giacobini, P., Gottgens, B., Guo, G., Hupalowska, A., James, K.R., Kirby, E., Kriegstein, A., Lundeberg, J., Marioni, J.C., Meyer, K.B., Niakan, K.K., Nilsson, M., Olabi, B., Pe'er, D., Regev, A., Rood, J., Rozenblatt-Rosen, O., Satija, R., Teichmann, S.A., Treutlein, B., Vento-Tormo, R., Webb, S. & Human Cell Atlas Developmental Biological
Nature 2021. 597: 196-205.
Unveiling the Importance of Tanycytes in the Control of the Dialogue Between the Brain and the Periphery.
Nampoothiri S, Duquenne M, Prevot V.
In: Tasker JG, et al., ed. Glial-Neuronal Signaling in Neuroendocrine Systems.
Masterclass in Neuroendocrinology Series. Switzerland: Springer Nature:255-284, 2021
2020
Animal Models to Understand the Etiology and Pathophysiology of Polycystic Ovary Syndrome.
Stener-Victorin E, Padmanabhan V, Walters KA, Campbell RE, Benrick A, Giacobini P, Dumesic DA, Abbott DH.
Endocr Rev. 2020. 41,538-76.
Nitric oxide signalling in the brain and its control of bodily functions.
Chachlaki K, Prevot V.
Br J Pharmacol. 2020,177:5437-5458.
2019
Emerging Roles of Anti-Müllerian Hormone in Hypothalamic-Pituitary Function.
Barbotin AL, Peigné M, Malone SA, Giacobini P.
Neuroendocrinology. 2019. 109,218-229.
Role of astrocytes, microglia, and tanycytes in brain control of systemic metabolism.
García-Cáceres C, Balland E, Prevot V, Luquet S, Woods SC, Koch M, Horvath TL, Yi CX, Chowen JA, Verkhratsky A, Araque A, Bechmann I, Tschöp MH.
Nat Neurosci. 2019. 22,7-14.
Don’t Trust Your Gut: When Gut Microbiota Disrupt Fertility.
Silva MSB, Giacobini P.
Cell Metab. 2019, 30:616-618. doi: 10.1016/j.cmet.2019.09.005.
New Developments in Reproductive and Stress Neuroendocrinology.
Prevot V, Millar RP.
Neuroendocrinology. 2019, 109:191-192. doi: 10.1159/000502420.
2018
Wired for eating: how is an active feeding circuitry established in the postnatal brain?
Muscatelli F, Bouret SG.
Curr Opin Neurobiol. 2018. 52, 165-171.
Sex and gender differences in developmental programming of metabolism.
Dearden L, Bouret SG, Ozanne SE.
Mol Metab. 2018.15, 8-19.
The special relationship: glia-neuron interactions in the neuroendocrine hypothalamus
Clasadonte J & Prevot V
Nature Reviews Endocrinology. 2018, 14:25-44.
The versatile tanycyte: a hypothalamic integrator of reproduction and energy metabolism
Prevot, V., B. Dehouck, A. Sharif, P. Ciofi, P. Giacobini, and J. Clasadonte.
Endocrine Reviews. 2018. doi: 10.1210/er.2017-00235.
2017
The gentle art of saying NO: how nitric oxide gets things done in the hypothalamus
Chachlaki K, Garthwaite J, Prevot V
Nature Reviews Endocrinology. 2017, 13:521-535.
When size matters: how astrocytic processes shape metabolism
Sharif A, Prevot V
Cell Metabolism. 2017, 25:995-996.
Articles grand public
2023
Minipuberty: A critical period for brain functional development.
Chachlaki K, Le Duc K, Storme L, Prévot V.
Med Sci (Paris). 2023;39(10):697-700. doi: 10.1051/medsci/2023113..PMID: 37943124 French. No abstract available.
Down syndrome, GnRH and cognition.
Prévot V, Pitteloud N.
Med Sci (Paris). 2023;39(4):316-318. doi: 10.1051/medsci/2023037..PMID: 37094260 French. No abstract available.
2021
Precocious puberty and neuropilin-1 signaling in GnRH neurons.
Vanacker C, Bouret SG, Giacobini P, Prévot V.
Med Sci (Paris). 2021 Apr;37(4):366-371. doi: 10.1051/medsci/2021035. Epub 2021 Apr 28.
2018
Rôle des réseaux astrocytaires métaboliques dans le maintien de l’éveil
Clasadonte J
Med Sci (Paris) 2017; 34(3):199-202
2017
Les micro-ARN Nouveaux acteurs du contrôle hypothalamique de la fertilité
Messina A, Langlet F, Prevot V
Med Sci (Paris) 2017; 33:506-511
Tanycytes hypothalamiques, barrière hématoencéphalique et rôle dans la régulation de l’homéostasie énergétique
Florent V, Baroncini M, Prevot V
Cahiers de Nutrition et de Diététique, 52)1):26-32
Développement des neurones à GnRH dans le cerveau d’embryons humains
Barbotin AL, Prevot V, Giacobini P
Medi Sci (Pari) 2017; 33:376-379