• Publications
• Brevets
• Thèses
Publications
2022
Denechaud M, Geurs S, Comptdaer T, Begard S, Garcia-Núñez A, Pechereau LA, Bouillet T, Vermeiren Y, de Deyn P, Perbet R, Deramecourt V, Vanderhaeghen M, Vanuytven S, Lefebvre B, Bogaert E, Deglon N, Voet T, Colin M, Buee L, Dermaut B*, Galas MC*. Nuclear tau confines oxidative stress-associated cycling neurons in S phase as a pro-survival mechanism in Alzheimer’s disease. Prog Neurobiol. In press
Manet C, Mansuroglu Z, Conquet L, Bortolin V, Comptdaer T, Segrt H, Menidjel R, Stadler N, Tian G, Herit F, Niedergang F, Souès S, Buée L, Galas MC*, Montagutelli X*, Bonnefoy E*. Zika virus infection of mature neurons from immunocompetent mice generates disease-associated microglia and a tauopathy-like phenotype in link with a delayed interferon beta response. J Neuroinflammation, in press
Launay A, Nebie O, Vijayashankara J, Lebouvier T, Buée L, Faivre E, Blum D. The role of adenosine A2A receptors in Alzheimer’s Disease and Tauopathies. Neuropharmacology, in press
Arandel L, Matloka M, Klein AF, Rau F, Sureau A, Ney M, Cordier A, Kondili M, Polay-Espinoza M, Naouar N, Ferry A, Lemaitre M, Begard S, Colin M, Lamarre C, Tran H, Buée L, Marie J, Sergeant N*, Furling D* (2022) Reversal of RNA toxicity in myotonic dystrophy via a decoy RNA-binding protein with high affinity for expanded CUG repeats. Nat Biomed Eng, 6(2):207-220.
Benderradji H, Vernotte E, Soto Ares G, Woillez JP, Perbet R, Karnoub MEA, Soudan B, Jannin A, Assaker R, Buee L, Prevot V, Maurage CA, Pigny P, Vantyghem MC, Merlen E, Cortet Rudelli C (2022) Efficacy of lanreotide 120 mg primary therapy on tumor shrinkage and ophthalmologic symptoms in acromegaly after one month. Clin Endocrinol (Oxf), 97(1):52-63.
Benderradji H, Kraiem S, Courty E, Eddarkaoui S, Bourouh C, Faivre E, Rolland L, Caron E, Besegher M, Oger F, Boschetti T, Carvalho K, Thiroux B, Gauvrit T, Nicolas E, Gomez-Murcia V, Bogdanova A, Bongiovanni A, Muhr-Tailleux A, Lancel S, Bantubungi K, Sergeant N, Annicotte JS, Buée L, Vieau D, Blum D, Buée-Scherrer V (2022) Impaired glucose homeostasis in a tau knock-in mouse model. Front Mol Neurosci, 15:841892
Bouillet T, Ciba M, Alves CL, Rodrigues FA, Thielemann C, Colin M, Buée L, Halliez S (2022) Revisiting tau involvement in complex neural network remodelling through analysis of extracellular neuronal activity exhibited by organotypic brain slice co-cultures. J Neural Eng, 19 066026.
Carracedo S, Briand-Amirat L, Dordas-Perpinyà M, Ramos Escuredo Y, Delcombel R, Sergeant N, Delehedde M. ProAKAP4 protein marker: Towards a functional approach to male fertility. Anim Reprod Sci. 2022 Sep 22;247:107074.
Chen SM, Hsu TC, Chew CH, Huang WT, Amanda C, Lin YF, Eddarkaoui S, Buee L, Chen CC (2022) Microtube Array Membrane Encapsulated Cell Therapy: a novel platform technology solution for treatment of Alzheimer’s disease (AD). Int J Mol Sci, 23(12):6855
Coku O, Mutez E, Eddarkaoui S, Carrier S, Marchand A, Deldycke C, Goveas L, Baille G, Tir M, Magnez R, Thuru X, Vermeersch G, Vandenberghe W, Buée L, Defebvre L, Sablonnière B, Chartier-Harlin MC, Taymans JM, Huin V (2022) Functional analyses of two novel LRRK2 pathogenic variants in familial Parkinson’s disease. Mov Disord, 37(8)1761-67.
Da Costa PJ, Hamdane M, Buée L, Martin F (2022) Tau mRNA Metabolism in Neurodegenerative Diseases: A Tangle Journey. Biomedecines 10(2): 241.
Danis C*, Dupré E*, Zejneli O*, Caillierez R, Arrial A, Bégard S, Mortelecque J, Eddarkaoui S, Loyens A, Cantrelle FX, Hanoulle X, Rain JC, Colin M, Buee L*, Landrieu I* (2022) Inhibition of Tau seeding by targeting Tau nucleation core within neurons with a single domain antibody fragment. Mol Ther, 30 (4):1484-1499
De Fisenne MA, Yilmaz Z, De Decker R, Suain V, Buée L, Ando K, Brion JP, Leroy K. Alzheimer PHF-tau aggregates do not spread tau pathology to the brain via the Retino-tectal projection after intraocular injection in male mouse models. Neurobiol Dis, in press
Delila L, Nebie O, Ngoc Le NT, Barro L, Chou ML, Wu YW, Watanabe N, Takahara M, Buée L, Blum D, Devos D, Burnouf T (2022) Neuroprotective activity of a virus-safe nanofiltered human platelet lysate depleted of extracellular vesicles in Parkinson’s disease and traumatic brain injury models. Bioeng Transl Med doi.org/10.1002/btm2.10360
Dewaeles E, Carvalho K, Fellah S, Sim J, Boukrout N, Caillierez R, Ramakrishnan H, Van der Hauwaert C, Vijaya Shankara J, Martin N, Massri N, Launay A, Folger JK, De Schutter C, Larrue R, Loison I, Goujon M, Jung M, Le Gras S, Gomez-Murcia V, Faivre E, Lemaire J, Garat A, Beauval N, Maboudou P, Gnemmi V, Gibier JB, Buee L, Abbadie C, Glowacki F, Pottier N, Perrais M, Cunha RA, Annicotte JS, Laumet G*, Blum D*, Cauffiez C*. Istradefylline (KW6002) protects from cisplatin-induced nephrotoxicity and peripheral neuropathy while preserving cisplatin anti-tumor effects. J Clin Invest 132(22):e152924. doi: 10.1172/JCI152924.
Dordas-Perpinyà M, Sergeant N, Ruelle I, Bruyas JF, Charreaux F, Michaud S, Carracedo S, Catalán J, Miró J, Delehedde M, Briand-Amirat L. ProAKAP4 Semen Concentrations as a Valuable Marker Protein of Post-Thawed Semen Quality and Bull Fertility: A Retrospective Study. Vet Sci. 2022 May 6;9(5):224.
Gauvrit T, Benderradji H, Buée L, Blum D, Vieau D (2022) Early-Life Environment Influence on Late-Onset Alzheimer's Disease. Front Cell Dev Biol, 10:834661.
Gomez-Murcia V, Carvalho K, Thiroux B, Caillierez R, Besegher M, Sergeant N, Buée L, Faivre E, Blum D (2022) Impact of chronic doxycycline treatment in the APP/PS1 mouse model of Alzheimer's disease. Neuropharmacology, 209:108999
Hanon O, Vidal JS, Lehmann S, Bombois S, Allinquant A, Tréluyer JM, Abdoul H, Gelé P, Delmaire C, Blanc F, Mangin JF, Buée L, Touchon J, Hugon J, Vellas B, Galbrun E, Benetos A, Berrut G, Paillaud E, Wallon D, Castelnovo G , Volpe-Gillot L, Paccalin M, Robert PH, Godefroy O, Camus V, Belmin J, Vandel P, Novella JL, Duron E, Rigaud AS, Schraen-Maschke S, Gabelle A on behalf of the BALTAZAR study group. Plasma β-amyloid (Aβ) as a relevant prognosis biomarker for conversion to dementia in subjects with mild cognitive impairment. The BALTAZAR Alzheimers Dement, doi: 10.1002/alz.12613
Lam S, Hérard AS, Boluda S, Petit F, Eddarkaoui S, Cambon K, Picq JL, Buée L, Duyckaerts C, Haïk S, Dhenain M (2022) Pathological changes induced by Alzheimer’s brain inoculation in amyloid-beta plaque-bearing mice. Acta Neuropathol Commun, 10:112
Leroux E, Perbet R, Caillierez R, Richetin K, Lieger S, Espourteille J, Bouillet T, Begard S, Danis C, Loyens A, Toni N, Deglon N, Deramecourt V, Schraen-Maschke S, Buee L*, Colin M* (2022) Extracellular vesicles: major actors of heterogeneity in tau spreading among human tauopathies. Mol Ther, 30 (2)782-97
Manfredi-Lozano M, Leysen V, Adamo M, Paiva I, Rovera R, Pignat JM, Fatima Ezzahra Timzoura F, Candlish M, Eddarkaoui S, Samuel A. Malone SA, Silva MSB, Trova S, Imbernon M, Tena-Sempere M, Claret M, Paoloni-Giacobino A, Plassard D, Emmanuelle Paccou E, Vionnet N, Acierno J, Maceski A, Lutti A, Pfrieger F, Rasika S, Santoni F, Boehm U, Ciofi P, Buée L, Haddjeri N, Boutillier AL, Kuhle J,Messina A, Draganski B, Giacobini P, Pitteloud N, Prevot V (2022) GnRH replacement rescues cognition in Down Syndrome. Science, 377(6610):eabq4515
Mesangeau C, Carato P, Renault N, Coevoet M, Larchanché PE, Barczyk A, Buée L, Sergeant N, Melnyk P. Discovery of Compounds That Selectively Repress the Amyloidogenic Processing of the Amyloid Precursor Protein: Design, Synthesis and Pharmacological Evaluation of Diphenylpyrazoles. Int J Mol Sci. 2022 Oct 28;23(21):13111.
Nebie O, Buée L, Blum D, Burnouf T (2022) Can the administration of platelet trophic factors to the brain help treat neurological disorders? Cell Mol Life Sci, 79(7):379
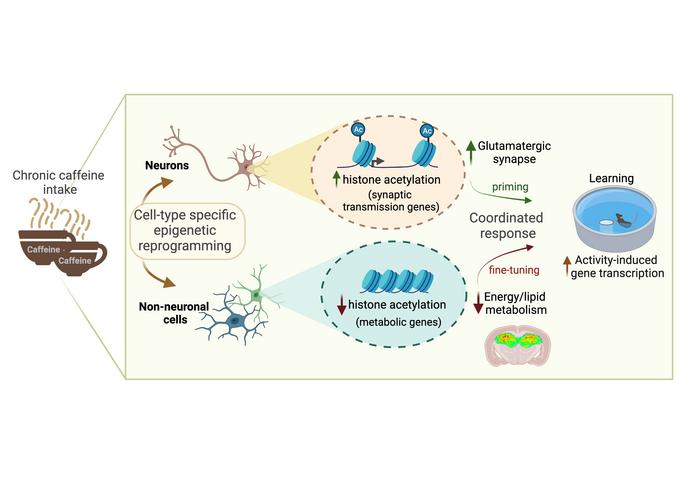
Paiva I, Cellai L, Mériaux C, Poncelet L, Papegaey A, Drobecq H, Le Gras S, Schneider M, Malik EM, Müller CE, Faivre E, Carvalho K, Gomez-Murcia V, Vieau D, Thiroux B, Eddarkaoui S, Lebouvier T, Schueller E, Seguin J, Stauber J, Lopes LV, Buée L, Buée-Scherrer V, Cunha RA, Ait-Belkacem R, Sergeant N, Annicotte JS, Boutillier AL, Blum D. Caffeine intake has a dual genome-wide effect on hippocampal metabolism and on learning-dependent transcription. J Clin Invest, 132(12):e149371
Petry S, Nateghi B, Keraudren R, Sergeant N, Planel E, Hébert SS, St-Amour I. Differential Regulation of Tau Exon 2 and 10 Isoforms in Huntington's Disease Brain. Neuroscience. 2022 Jul 19:S0306-4522(22)00367-0.
Rousset M, Humez S, Laurent C, Buée L, Blum D, Cens T, Vignes M, Charnet P (2022) Mammalian brain Ca2+ channel activity transplanted into Xenopus laevis oocytes. Membranes, 12(5)496.
Sexton C, Snyder H, Beher D, Boxer AL, Brannelly P, Brion JP, Buée L, Cacace AM, Chételat G, Citron M, DeVos SL, Diaz K, Feldman HH, Frost B, Goate AM, Gold M, Hyman BT, Johnson K, Karch CM, Kerwin DR, Koroshetz WJ, Litvan I, Morris HR, Mummery CJ, Mutamba J, Patterson MC, Quiroz YT, Rabinovici GD, Rommel A, Shulman MB, Toledo-Sherman LM, Weninger S, Wildsmith KR, Worley SL, Carrillo MC. Current directions in tau research: Highlights from Tau 2020. Alzheimers Dement, 2021, 1-20. https://doi.org/10.1002/alz.12452
Wang GS, Wang LH, Lin CY, Lin YM, Buée L, Sergeant N, Blum D, Chern Y (2022) Calpain-2 mediates MBNL2 degradation and a developmental RNA processing program in neurodegeneration. J Neurosci, 42:5102-14
Bertin E, Martinez A, Fayoux A, Carvalho K, Carracedo S, Fernagut PO, Koch-Nolte F, Blum D, Bertrand SS & Boué-Grabot E (2022) Increased surface P2X4 receptors by mutant SOD1 proteins contribute to ALS pathogenesis in SOD1-G93A mice. Cell Mol Life Sci 79(8):431.
Bantubungi K, Vieau D, Blum D*, Ferreira S* Uncovering bidirectional brain-body interactions in health and disease (2022) Neuropharmacology 5(1):91.
2021
Blum D, Lopes LV (2021) Stabilizing synapses. Science 374(6568):684-685. doi: 10.1126/science.abm3902
Brigas HC, Ribeiro M, Coelho JE, Gomes R, Gomez V, Carvalho K, Faivre E, Pereira S, Darrigues J, Antunes de Almeida A, Buée L, Dunot J, Marie H, Pousinha PA, Blum D, Silva-Santos B, Lopes LV, Ribot JC. IL-17 triggers the onset of cognitive and synaptic deficits in early stages of Alzheimer's disease. Cell Reports, 36(9):109574
Carvalho K, Martin E, Cès A, Sarrazin N, Youssef I, Lagouge-Roussey P, Prigent A, Boluda S, Huin V, Fontaine B, Buée L, Delatour B, Dutar P, Sennlaub F, Guillonneau X, Blum D, Delarasse C. P2X7-deficiency rescues plasticity and cognitive deficits in a mouse model of Tauopathy. Prog Neurobiol, 206:102139
Chang CP, Chang YG, Chuang PY; Thi Ngoc Nguyen A; Wu KC, Chou FY; Cheng SJ, Chen HM, Jin LW, Carvalho K, Huin V, Buée L, Liao YF, Lin CJ, Blum D, Chern Y. ENT1 inhibition rescues energy dysfunction and pathology in a model of tauopathy. Acta Neuropathol Commun 9(1) 112
Damotte V, van der Lee SJ, Chouraki V, Grenier-Boley B, Simino J, Adams H, Tosto G, White C, Terzikhan N, Cruchaga C, Knol MJ, Li S, Schraen S, Grove ML, Satizabal C, Amin N, Berr C, Younkin S, Alzheimer’s Disease Neuroimaging Initiative, Gottesman RF, Buée L, Beiser A, Knopman DS, Uitterlinden A, DeCarli C, Bressler J, DeStefano A, Dartigues JF, Yang Q, Boerwinkle E, Tzourio C, Fornage M, Ikram MA, Amouyel P, de Jager P, Reitz C, Mosley Jr TH, Lambert JC, Seshadri S, Van Duijn C (2021) Plasma amyloid β levels are driven by genetic variants near APOE, BACE1, APP, PSEN2: A genome-wide association study in over 12,000 non-demented participants. Alzheimers Dement, 17(10):1663-1674
Hartnell IJ, Blum D, Nicoll JAR, Dorothee G, Boche D (2021) Glial cells and adaptive immunity in frontotemporal dementia with tau pathology. Brain. 144(3):724-745. doi: 10.1093/brain/awaa457. PMID: 33527991.
Lam S, Petit F, Hérard AS, Boluda S, Eddarkaoui S, Guillermier M, The Brainbank Neuro-CEB Neuropathology Network, Buée L, Duyckaerts C, Haïk S, Picq JL, Dhenain M (2021) Amyloid and tau pathologies, cognitive impairments and cerebral atrophy after Alzheimer brain extracts inoculation in a primate. Acta Neuropathol Commun, 9(1):165.
Lantoine J, Procès A, Villers A, Halliez S, Buée L, Ris L, Gabriele S (2021) Inflammatory molecules released by mechanically injured astrocytes trigger pre-synaptic loss in cortical neuronal networks. ACS Chem Neurosci, 12(20):3885-3897
Leroy M, Bertoux M, Skrobala E, Mode E, Adnet-Bonte C, Le Ber I, Bombois S, Cassagnaud P, Chen Y, Deramecourt V, Lebert F, Mackowiak MA, Sillaire AR, Wathelet M, Pasquier F, Lebouvier T; Méotis network (2021) Characteristics and progression of patients with frontotemporal dementia in a regional memory clinic network. Alzheimers Res Ther. 13(1):19. doi: 10.1186/s13195-020-00753-9.
Maté de Gérando A, d'Orange M, Augustin E, Joséphine C, Aurégan G, Gaudin-Guérif M, Guillermier M, Hérard AS, Stimmer L, Petit F, Gipchtein P, Jan C, Escartin C, Selingue E, Carvalho K, Blum D, Brouillet E, Hantraye P, Gaillard MC, Bonvento G, Bemelmans AP, Cambon K (2021) Neuronal tau species transfer to astrocytes and induce their loss according to tau aggregation state. Brain. 144(4):1167-1182. doi: 10.1093/brain/awab011.
Nebie O, Carvalho K, Barro L, Delila L, Faivre E, Renn TY, Chou ML, Wu YW, Nyem-Erdene A, Chou SY, Buée L, Hu CJ, Peng CW, Devos D, Blum D, Burnouf T (2021) Human platelet secretome brain administration for traumatic brain injury: pre-clinical assessment. Brain, 144(10) 3142-58.
Nebie O, Barro L, Wu YW, Knutson F, Buée L, Devos D, Peng CW, Blum D, Burnouf T (2021) Heat-treated human platelet lysate modulates microglia activation, favors wound healing and promotes neuronal differentiation in vitro. Platelets, 32(2): 226-37. doi: 10.1080/09537104.2020.1732324
Nyam-Erdene A, Nebie O, Delila L, Buée L, Devos D, Chou SY, Blum D, Burnouf T (2021) Characterization and Chromatographic Isolation of Platelet Extracellular Vesicles from Human Platelet Lysates for Applications in Neuroregenerative Medicine. ACS Biomater Sci Eng, 7(12): 5823-5835. doi: 10.1021/acsbiomaterials.1c01226.
Pietrowski MJ, Gabr AA, Kozlov S, Blum D, Halle A, Carvalho K (2021) Glial Purinergic Signaling in Neurodegeneration. Front Neurol. 12:654850. doi: 10.3389/fneur.2021.654850.
Rico T, Gilles M, Chauderlier A, Comptdaer T, Magnez R, Chwastyniak M, Drobecq H, Pinet F, Thuru X, Buee L, Galas MC, Lefebvre B (2021) Tau stabilizes chromatib compaction. Cell Dev. Biol - Cellular Biochemistry, 9:740550
Susloparova A, Halliez S, Begard S, Colin M, Buée L, Pecqueur S, Alibart F, Thomy V, Arscott S, Pallecchi E, Coffinier Y (2021) Low impedance and highly transparent microelectrode arrays (MEA) for in vitro neuron electrical activity probing. Sens Actuators B Chem, 327:128895
Tautou M, Eddarkaoui S, Descamps F, Larchanché PE, El Bakali J, Goveas LM, Dumoulin M, Lamarre C, Blum D, Buee L, Melnyk P, Sergeant N (2021) A β‐secretase modulator decreases Tau pathology and preserves short-term memory in a mouse model of neurofibrillary degeneration. Front Pharmacol, 12:679335.
Vaillant-Beuchot L, Mary A, Pardossi-Piquard R, Bourgeois A, Lauritzen I, Eysert F, Kinoshita PF, Cazareth J, Badot C, Fragaki K Bussiere R, Martin C, Mary R, Bauer C, Pagnotta S, Paquis-Flucklinger V, Buée-Scherrer V, Buée L, Lacas-Gervais S, Checler F, Chami M (2021) Amyloid precursor protein C-terminal fragments accumulation triggers mitochondrial structure, function and mitophagy defects in Alzheimer’s disease models and human brains. Acta Neuropathol, 141(1): 39-65.
Vautheny A, Duwat C, Auregan G, Joséphine C, Hérard AS, Jan C, Mitja J, Gipchtein P, Gaillard MC, Buée L, Blum D, Hantraye P, Bonvento G, Brouillet E, Cambon K, Bemelmans AP (2021) THY-Tau22 mouse model accumulates more tauopathy at late stage of the disease in response to microglia deactivation through TREM2 deficiency. Neurobiol Dis, 155:105398. doi: 10.1016/j.nbd.2021.105398.
Wang ZH, Xia Y, Wu Z, Kang SS, Zhang JC, Liu P, Liu X, Song W, Huin V, Dhaenens CM, Yu SP, Wang XC, Ye K (2021) Neuronal ApoE4 stimulates C/EBPβ activation, promoting Alzheimer's disease pathology in a mouse model. Prog Neurobiol. 209:102212. doi: 10.1016/j.pneurobio.2021.102212.
2020
Ando K, De Decker R, Vergara C, Yilmaz Z, Mansour S, Suain V, Sleegers K, de Fisenne MA, Houben S, Potier MC, Duyckaerts C, Watanabe T, Buée L, Leroy K, Brion JP (2020) Picalm reduction exacerbates tau pathology in a murine tauopathy model. Acta Neuropathol, 139:773–89 doi:10.1007/s00401-020-02125-x
Ahmed T, Van Der Jeugd A, Caillierez R, Buee L, Blum D, D'Hooge R, Balschun D (2020) Chronic sodium selenate treatment restores deficits in cognition and synaptic plasticity in a murine model of tauopathy. Front Mol Neurosci, 13:570223. doi: 10.3389/fnmol.2020.570223
Bourefis AR, Campanari ML, Buee-Scherrer V, Kabashi E. Functional characterization of a FUS mutant zebrafish line as a novel genetic model for ALS. Neurobiol Dis. 142:104935. doi: 10.1016/j.nbd.2020.104935.
Colin M, Dujardin S, Schraen-Maschke S, Meno-Tetang G, Duyckaerts C, Courade JP, Buée L (2020) Exploring anti-tau immunotherapy within the hypothesis of the prion-like propagation. Acta Neuropathol, 139: 3-25
Degiorgis L, Karatas M, Sourty M, Faivre E, Lamy J, Noblet V, Bienert T, Reisert M, von Elverfeldt D, Buée L, Blum D, Boutillier AL, Armspach JP, Blanc F, Harsan LA (2020) Remodeling of cerebral networks architecture anticipate behavioral deficits in a tauopathy mouse model of Alzheimer's disease. Brain, 143(12):3748-3762. doi: 10.1093/brain/awaa312.
Duriez P, Eddarkaoui S, Blum D, Dickson SL, Gorwood P, Tolle V, Viltart O (2020) Does physical activity associated with chronic food restriction alleviate anxiety like behaviour, in female mice? Horm Behav. 124:104807. doi: 10.1016/j.yhbeh.2020.104807.
Gomez-Murcia V, Sandau U, Ferry B, Parrot S, Laurent C, Basquin M, Buée L, Boison D, Blum D (2020) Hyperexcitability and seizures in the THY-Tau22 mouse model of Tauopathy. Neurobiol Aging, 94: 265-270.
Hector A, McAnulty C, Piché-Lemieux ME, Alves-Pires C, Buée-Scherrer V, Buée L*, Brouillette J* (2020) Tau hyperphosphorylation induced by the anesthetic agent ketamine- xylazine involved the calmodulin-dependent protein kinase II. FASEB J, 34(2):2968–77
Homa M, Loyens A, Eddarkaoui S, Faivre E, Deramecourt V, Maurage CA, Buée L, Huin V, Sablonnière B (2020) The TMEM240 Protein, Mutated in SCA21, Is Expressed in Purkinje Cells and Synaptic T Cerebellum 19(3):358‐369. doi:10.1007/s12311-020-01112-y
Richetin K, Steullet P, Pachoud M, Perbet R, Parietti E, Maheswaran M, Eddarkaoui S, Bégard S, Pythoud C, Rey M, Caillierez R, Do KQ, Halliez S, Bezzi P, Buee L, Leuba G, Colin M, Toni N, Déglon N (2020) Tau accumulation in astrocytes of the dentate gyrus induces neuronal dysfunction and memory deficits in Alzheimer’s disease. Nature Neurosci, 23(12): 1567-79. https://doi.org/10.1038/s41593-020-00728-x
Runhart EH, Khan M, Cornelis SS, Roosing S, Del Pozo-Valero M, Lamey TM, Liskova P, Roberts L, Stöhr H, Klaver CCW, Hoyng CB, Cremers FPM, Dhaenens CM; Disease Consortium Study Group (2020) Association of Sex With Frequent and Mild ABCA4 Alleles in Stargardt Disease. JAMA Ophthalmol. 138(10):1035-1042. doi: 10.1001/jamaophthalmol.2020.2990.
Sierksma A, Lu A, Salta E, Mancuso R, Zoco J, Blum D, Buée L, De Strooper B, Fiers M (2020) Novel Alzheimer risk genes determine the microglia response to amyloid ß but not to TAU pathology. EMBO Mol Med, 12(3): e10606.
Temido-Ferreira M, Ferreira DG, Batalha VL, Marques-Morgado I, Coelho JE, Pereira P, Gomes R, Carvalho S, Canas PM, Cuvelier L, Buée-Scherrer V, Faivre E, CE, Pimentel J, Schiffmann SN, Buée L, Outeiro TF, Bader M, Blum D, Cunha RA, Marie H, Pousinha PA, Lopes LV (2020) Age-related shift in LTD is dependent on neuronal adenosine A2A receptors interplay with mGluR5 and NMDA receptors. Mol Psychiatr, 25(8):1876-1900
Verelst J, Geukens N, Eddarkaoui S, Vliegen D, De Smidt E, Rosseels J, Franssens V, Molenberghs S, Francois C, Stoops E, Bjerke M, Engelborghs S, Laghmouchi M, Carmans S, Buée L, Vanmechelen E, Winderickx J, Thomas D (2020) A Novel Tau Antibody Detecting the First Amino-Terminal Insert Reveals Conformational Differences Among Tau Isoforms. Front Mol Biosci, 7:48. doi:10.3389/fmolb.2020.00048
Zheng J, Akbari M, Schirmer C, Reynaert ML, Loyens A, Lefebvre B, Buée L, Croteau DL, Galas MC, Bohr VA (2020) Hippocampal tau oligomerization early in tau pathology coincides with a transient alteration of mitochondrial homeostasis and DNA repair in a mouse model of tauopathy. Acta Neuropathol Commun, 8(1):25. doi:10.1186/s40478-020-00896-8
2019
Albert M, Mairet-Coello G, Danis C, Lieger S, Caillierez R, Carrier S, Skrobala E, Landrieu I, Michel A, Schmitt M, Citron M, Downey P, Courade JP, Buée L*, Colin M* (2019) Prevention of tau seeding and propagation by immunotherapy with a central tau epitope antibody. Brain, 142(6): 1736-1750
Carvalho K, Faivre E, Pietrowski MJ, Marques X, Gomez-Murcia V, Deleau A, Huin V, Hansen JN, Kozlov S, Danis C, Temido-Ferreira M, Coelho JE, Mériaux C, Eddarkaoui S, Le Gras S, Dumoulin M Cellai L, NeuroCEB Brain Bank, Landrieu I, Chern Y, Hamdane M, Buée L, Boutillier AL, Levi S, Halle A, Lopes LV, Blum D (2019) Exacerbation of C1q dysregulation, synaptic loss and memory deficits in Tau pathology linked to neuronal adenosine A2A receptors. Brain, 142(11): 3636-54
Corvol JC, Buée L (2019) A new step towards targeting tau. Lancet Neurol, 18:517-8.
Domise M, Sauvé F, Didier S, Caillerez R, Bégard S, Carrier S, Colin M, Marinangeli C, Buee L, Vingtdeux V (2019) Neuronal AMP-activated protein kinase (AMPK) hyper-activation induces synaptic loss by an autophagy mediated process. Cell Death Dis, 10:221
Dupré E, Danis C, Arrial A, Cantrelle FX, Merzougui H, Hanoulle X, Colin M, Rain JC, Buée L*, Landrieu I* (2019) Single chain antibody fragments as new tools for studying the neuronal Tau protein physiopathology. ACS Chemical Neurosci, 10(9):3997-4006
Faldini E, Ahmed T, Buee L, Blum D, Balschun D (2019) Tau- but not Aß -pathology enhances NMDAR-dependent depotentiation in AD-mouse models. Acta Neuropathol Comm, 7:202
Fichou Y, Al-Hilaly YK, François Devred F, Smet-Nocca C Tsvetkov PO, Verelst J, Winderickx J, Geukens N, Vanmechelen E, Perrotin A, Serpell L, Hanseeuw B, Medina M, Buée L*, Landrieu I* (2019) The elusive Tau Molecular structures: Can we translate the recent breakthroughs into new targets for intervention? Acta Neuropathol Commun, 7:31
Gary C, Lam S, Herard AS, Koch JE, Petit F, Gipchtein P, Sawiak SJ, Caillierez R, Eddarkaoui S, Colin M, Aujard F, Deslys JP, French neuropathology network, Brouillet E, Buée L, Comoy EE, Pifferi F, Picq JL, Dhenain M (2019) Encephalopathy induced by Alzheimer brain inoculation in a non-human primate. Acta Neuropathol Commun, 7(1)126.
Houben S, Leroy K, Ando K, Yilmaz Z, Widomski C, Buée L, Brion JP (2019) Genetic ablation of tau in postnatal neurons rescues decreased adult hippocampal neurogenesis in a tauopathy model. Neurobiol Dis, 127:131-141
Ising C, Venegas C, Zhang S, Scheiblich H, Schmidt SV, Vieira-Saecker A, Schwartz S, Albasset S, McManus R, Tejera D, Griep A, Santarelli F, Brosseron F, Opitz S, Stunden J, Merten M, Kayed R, Golenbock D, Blum D, Latz E, Buee L, Heneka M (2019) NLRP3 inflammasome activation drives tau pathology. Nature, 575(7784): 669-673
Jadhav S, Avila J, Schöll M, Kovacs G, Kövari E, Skrabana R, Evans L, Kontsekova E, Malawska B, de Silva R, Buée L*, Zilka N* (2019) A walk through tau therapeutic strategies. Acta Neuropathol Commun, 7: 22.
Leboucher A, Ahmed T, Caron E, Tailleux A, Raison S, Joly Amado A, Marciniak E, Carvalho K, Hamdane M, Bantubungi K, Lancel S, Eddarkaoui S, Caillierez R, Vallez E, Staels B, Vieau D, Balschun D, Buée L*, Blum D* (2019) Brain insulin response and peripheral metabolic changes in a Tau transgenic mouse model. Neurobiol Dis, 125 :14-22.
Lemaire Q, Raffo-Romero A, Arab T, Van Camp C, Drago F, Forte S, Gimeno JP, Begard S, Colin M, Vizioli J, Sautière PE, Salzet M, Lefebvre C (2019) Isolation of microglia-derived extracellular vesicles: towards miRNA signatures and neuroprotection. J Nanobiotechnology. 17(1):119. doi: 10.1186/s12951-019-0551-6.
Loera-Valencia R, Cedazo-Minguez A, Kenigsberg PA, Page G, Duarte A, Giusti P, Zusso M, Robert P, Frisoni G, Cattaneo A, Zille M, Boltze J, Cartier N, Buee L, Johansson G, Winblad B (2019) Current and emerging avenues for Alzheimer’s disease drug targets. J Intern Med, 286(4):398-437
Nebie O, Devos D, Vingtdeux V, Barro L, Devedjian JC, Jonneaux A, Chou ML, Bordet R, Buée L, Knutson F, Blum D, Burnouf T (2019) The neuroprotective activity of heat-treated human platelet lysate biomaterials manufactured from outdated pathogen-reduced (amotosalen/UVA) platelet concentrates. J Biomed Sci, 26(1):89. doi: 10.1186/s12929-019-0579-9
Paiva I, Carvalho K, Cellai L, Santos P, Pavlou MAS, Jain G, Gnad T, Pfeifer A, Vieau D, Fischer A, Buée L, Outeiro TF, Blum D (2019) A2AR-induced transcriptional deregulation in astrocytes: an in vitro Glia, 67(12):2329-2342
Sergeant N, Vingtdeux V, Eddarkaoui S, Gay M, Le Fur N, Evrard C, Laurent C, Caillierez R, Obriot H, Larchanché PE, Farce A, Coevoet M, Carato P, Kouach M, Descat A, Dallemagne P, Buée-Scherrer V, Hamdane M, Buee L, Melnyk P (2019) New piperazine multi-effect drugs prevent neurofibrillary degeneration and amyloid deposition, and preserve memory in animal models of Alzheimer’s disease. Neurobiol Dis, 129: 217-33.
Shrivastava AN, Redeker V, Pieri L, Bousset L, Renner M, Madiona K, Mailhes-Hamon C, Coens A, Buée L, Hantraye P, Triller A, Melki R (2019) Clustering of tau fibrils impairs the synaptic composition of a3-Na+/K+-ATPase and AMPA receptors. EMBO J, 38, e99871
Zappettini S, Faivre E, Ghestem A, Carrier S, Buée L, Blum D, Esclapez M, Bernard C (2019) Caffeine Consumption During Pregnancy Accelerates the Development of Cognitive Deficits in Offspring in a Model of Tauopathy. Front Cell Neurosci; 13: 438. doi: 10.3389/fncel.2019.00438.
Brevets
Brevets déposés
- EP17210486.1 Cauffiez C, Perrais M, Blum D. KIT-OF-PARTS COMPRISING A NEPHROTOXIC CHEMOTHERAPEUTIC DRUG AND A SELECTIVE A2A ADENOSINE RECEPTOR ANTAGONIST. December 22, 2017.
- EP17305355.4 Hamdane M, Derisbourg M, Leghay C, Chiappetta G, Verdier Y, Vinh J, Blum D, Buée L. New Tau species. March 28, 2017.
Brevets acceptés
- WO2015068075 – Buée L, Colin M, Hantraye P, Aron Badin R, Dujardin S, Bemelmans A, Brouillet E. DETECTION OF TAU.
- WO2014096321 – Buée L, Troquier L, Lassalle P. ANTIBODIES SPECIFIC TO TAU PHOSPHORYLATED AT SERINE 422 AND USES FOR THE TREATMENT AND DIAGNOSIS OF TAUOPATHIES.
Brevets licenciés
- US20160356785 Sergeant N, Mitchell V, Jumeau F, Sigala J. Methods for determining human sperm quality. Licence exclusive à 4BioDx.
- WO2016146655 : Sergeant N, Melnyk P, Buée L. Novel 1,4-bis(3-aminopropyl)piperazine derivatives and its use. 16 mars 2015 (Accord de licence en discussion avec la société Alzprotect).
- WO2015032842 : Sergeant N, Mitchell V, Jumeau F, Sigala J. Méthodes de détermination de la qualité du sperme humain. Licence exclusive à 4BioDx.
- WO2014102339 : Barrier M, Buée L, Burlet S, Delacourte A, Estrella C, Melnyk P, Sergeant N, Verwaerde P. Sulfate salts of N-(3-(4-(3-(diisobutylamino)propyl)piperazin-1-yl)propyl)-1H-benzo[d]imidazol-2-amine. AlzProtecT – phase I terminée en 2015.
- W02006051489 : Melnyk Patricia, Sergeant Nicolas, Buée Luc, Delacourte André, Inserm, Université de Lille II, « Use of 1, 4-bis(3 aminopropyl)piperazine derivatives in therapy ». http://www.wipo.int/pctdb/en/wo.jsp?WO=2006051489 Licensed to AlzProtecT.
Molécule actuellement en essai clinique chez l’homme – phase I terminée en 2015.
Thèses
Thèses en cours
- DENECHAUD Marine (D1 en 2018 – dir. thèse : Marie-Christine GALAS)
- GUEDJDAL Sarah (D1 en 2017 – dir. thèse : Malika HAMDANE)
- NEBIE Ouada (D1 en 2017 – dir. thèse : David BLUM et Thierry BURNOUF)
- LEROUX Elodie (D1 en 2018 – dir. thèse : Morvane COLIN)
- LEROY Melanie (D1 en 2018 – dir. thèse : Vincent DERAMECOURT)
- PERBET Romain (D1 en 2017 – dir. thèse : Morvane COLIN)
- RICO Thomas (D1 en 2018 – dir. thèse : Bruno LEFEBVRE)
- SOUSA Cristiano (D1 en 2018 – dir. thèse : Malika HAMDANE et Karen VANHOORELBEKE)
- TAUTOU Marie (D1 en 2018 – dir. thèse : Nicolas SERGEANT)
- ZEJNELI Orgeta (D1 en 2018 – dir. thèse : Luc BUEE et Isabelle LANDRIEU)
Thèses soutenues depuis 2017
- HOMA Mégane (Sout. le 14/01/2020) sous la direction de Bernard Sablonnière
- CARVALHO Kevin (sout.le 14/10/2019 sous la direction de David Blum) (titre/résumés)
- ERDUAL Edmone (sout.le 05/11/2019sous ladirection de Nicolas Pottier) (titre/résumés)
- ALBERT Marie (sout. le 10/12/2018 sous la direction de Morvane COLIN) (titre/résumés)
- DANIS Clément (soutenance le 14/12/2018 sous la direction de Isabelle LANDRIEU et Luc BUEE) (titre/résumés)
- DOMISE Manon (soutenance le 17/12/2018 sous la direction de Valerie VINGTDEUX) (titre/résumés)
- EVRARD Caroline (sout. le 20/11/2018 sous la direction de Nicolas SERGEANT) (titre/résumés)
- GILLES Melissa (sout. le 13/11/2018 sous la direction de Bruno LEFEBVRE) (titre/résumés)
- TARDIVEL-SAFI Meryem (sout. le 6/12/2017 sous la direction de : Morvane COLIN) (titre/résumés)
- LEGHAY Coline (sout. le 19/09/2017 sous la direction de : Malika HAMDANE (titre/résumés)